
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики, формулировки, математическое выражение
|
|
|
|
Лекция 3. Второй закон термодинамики. Понятие об энтропии
Вопросы для самопроверки
1. Какие уравнения реакций называются термохимическими?
2. Что называется тепловым эффектом химической реакции?
3. Докажите, что закон Гесса – частный случай первого закона термодинамики. При постоянном давлении тепловой эффект реакции Qр = ΔН, а при постоянном объеме Qv = ΔU, и поэтому не зависит от промежуточных реакций.
4. Дайте определение понятия «стандартное состояние вещества».
5. Что называется теплотами образования и сгорания веществ?
6. Как рассчитывается тепловой эффект химических реакций по теплотам образования и сгорания при стандартных условиях?
7. Приведите уравнение Кирхгофа в интегральной форме и поясните, для каких практических целей оно используется.
8. При каких условиях тепловой эффект реакции не зависит от температуры. Какой физический смысл величины ΔНо в выражении ΔН=ΔНо + ∫ΔСрdТ?
9. В каких случаях расчет теплового эффекта химических реакций с применением закона Гесса и следствий из него, может привести к неточным расчетам?
3.1 Второй закон термодинамики, формулировки, математическое выражение
3.2 Понятие об энтропии, расчет изменения энтропии в различных равновесных процессах
3.3 Энтропия как критерий направленности и равновесия процессов в изолированных системах
Основными положениями первого закона термодинамики являются утверждения о постоянстве количества внутренней энергии, содержащейся в изолированной системе, об эквивалентности различных форм энергии, а также соотношения, связывающие изменения внутренней энергии системы с количеством поступившей теплоты и произведённой работы. При этом первый закон не касается характера, возможности и направления тех процессов, при которых могут или будут происходить те или иные превращения энергии.
|
|
|
Второй закон определяет прежде всего, какие из процессов в рассматриваемой системе при заданных температуре, давлении, концентрации и прочих параметрах могут протекать самопроизвольно (т.е. без затраты работы извне), какое количество работы может быть получено при этом, каков предел возможного самопроизвольного протекания процесса.
Второй закон термодинамики даёт возможность определить, какими должны быть внешние условия, чтобы интересующий нас процесс мог происходить в нужном направлении и в требуемой степени. Для процессов, требующих затраты энергии извне, с помощью второго закона можно оценить количество работы, необходимое для определенного процесса, и зависимость этого количества от внешних условий. Второй закон термодинамики применим лишь к системам с большим числом частиц, т.е. таким, поведение которых может быть выражено законами статистики.
Все термодинамические процессы делятся на:
1) положительные,
2) отрицательные,
3) равновесные.
Процессы, протекающие самопроизвольно, называются положительными. Например, опускание груза с высокого на более низкий уровень, взаимная нейтрализация сильной кислоты и сильного основания, любая химическая реакция, используемая в работающем элементе, сгорание углеводородов, ржавление железа и др.
Самопроизвольные процессы в природе – это необратимые процессы. Они идут без затраты энергии, наоборот с их помощью можно получить работу. Положительные процессы приближают систему к состоянию равновесия.
Процессы, обратные положительным, называются отрицательными. Они протекают только при затрате энергии извне. В результате отрицательного процесса система удаляется от состояния равновесия.
|
|
|
Равновесные процессы являются пограничными между положительными и отрицательными, так как они идут через непрерывный ряд равновесных состояний системы.
Первый закон термодинамики не позволяет предсказать, будет ли данный процесс положительным или отрицательным. Например, сам переход теплоты от холодного тела к горячему не противоречит первому закону, также как и разложение СО2 или Н2О при комнатной температуре.
На вопрос о том, пойдет ли данный процесс (химическая реакция) самопроизвольно, и какими параметрами будет характеризоваться система, когда в ней установится термодинамическое равновесие, можно получить ответ с помощью второго закона термодинамики. Второй закон термодинамики – критерий, определяющий принципиальную возможность и направление протекания процесса.
Второй закон термодинамики – постулат, он был сформулирован значительно раньше первого закона термодинамики. Возник на основе анализа действия тепловых машин. В 1824 г. французский инженер Карно установил зависимость между исчезающей теплотой и возникающей работой. Он показал, что получение работы за счет запаса теплоты происходит только благодаря переносу теплоты от более нагретого к менее нагретому телу.
Схема циклического процесса в тепловой машине
В любой тепловой машине теплота превращается в работу. Схема циклического процесса, который происходит в тепловой машине, показана на рисунке: 3.1. Рабочее тело получает от нагревателя (теплоотдатчика) с температурой Т1 теплоту Q1 и совершает работу А. При этом только часть теплоты превращается в работу, а остальная часть Q2 переходит к холодильнику с температурой Т2 и рассеивается в окружающую среду (причем Т2 < Т1). Совершаемая работа А = Q1 – Q2.
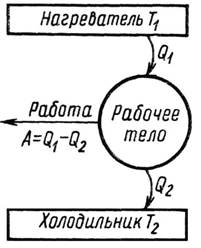
Рис. 3.1 Схема циклического процесса в простейшей тепловой машине
Экономичность указанного цикла оценивается величиной коэффициента полезного действия (КПД): он не зависит от природы рабочего вещества, зависит от Т1 и Т2:
 (3.1)
(3.1)
КПД является функцией температур Т1 и Т2 η =ƒ (T1,T2), изменяется в интервале 0< h <1, h=1, или 100 %, если Т2=0, h=0, если T2 = T1.
Для элементарного процесса T1 и T2 мало отличаются, поэтому
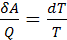 (3.2)
(3.2)

где 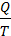 – приведенная теплота.
– приведенная теплота.
|
|
|
Оба уравнения являются математическим выражением второго закона термодинамики. Формулировки второго закона термодинамики весьма многочисленны. Второй закон термодинамики, как и первый, был сформулирован как постулат, подтверждённый опытным материалом. Второй закон был обоснован в работах Клаузиуса (1850) и В. Томсона (1851).
В качестве исходного постулата можно принять следующее утверждение:
теплота не может переходить самопроизвольно от более холодного тела к более тёплому,
высказанное в несколько иной форме русским ученым М. В. Ломоносовым ещё в 1747г.
Невозможен процесс, единственным результатом которого было бы превращение теплоты в работу,
или
невозможно построить такую машину, все действия которой сводились бы к производству работы и соответствующему охлаждению теплового источника.
Постулат Клаузиуса: Теплота не может переходить самопроизвольно от холодного тела к горячему, т.е. невозможен процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Постулат Томсона: Теплота наиболее холодного из участвующих в процессе тел не может служить источником работы.
Вечный двигатель второго рода невозможен, т.е. нельзя построить такую машину, которая бы работала за счет теплоты окружающей среды без разности температур.
Приведенные постулаты нельзя доказать. Их справедливость подтверждается опытом и неизвестны случаи, которые противоречили бы этим постулатам.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2883; Нарушение авторских прав?; Мы поможем в написании вашей работы!