
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энергии Гиббса с температурой и давлением
|
|
|
|
Известно, что энергия Гиббса связана с энтальпией и энтропией веществ соотношением:

или (5.16)
 .
.
Продифференцируем энергию Гиббса по всем переменным:
 . (5.17)
. (5.17)
Но для равновесных процессов:
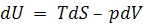 .
.
Тогда предыдущее выражение запишется:
 . (5.18)
. (5.18)
По анологии для 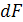 можно получить соотношение:
можно получить соотношение:
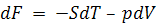 . (5.19)
. (5.19)
Зависимость  выражается формулой:
выражается формулой:
 (5.20)
(5.20)
Следовательно
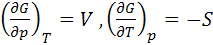 (5.21)
(5.21)
Пусть имеет место изотермический процесс. Тогда при Т= const
 . (5.22)
. (5.22)
Интегрирование последнего соотношения от начального (1) до конечного (2) состояния позволяет рассчитать dG веществапри любом давлении.
Для твердых и жидких тел при V = const:
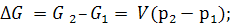 (5.23)
(5.23)
Для идеальных и реальных газов
 (5.24)
(5.24)
Таким образом, с повышением давления энергия Гиббса растет, ∆G>0, если р2 > р1 при Т = const.
В условиях изобарного процесса при Р=const
 ,
,
Если  или
или
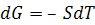 . (5.25)
. (5.25)
В простейшем случае при S = const (отсутствие фазовых превращений, малая разность Т) при интегрировании последнего выражения получим:
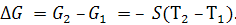 (5.26)
(5.26)
Следовательно, с повышением температуры энергия Гиббса падает:
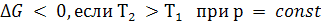 (5.27)
(5.27)
Таким образом, по итогам рассмотрения первого и второго законов термодинамики мы имеем четыре функции состояния, которые носят общее название – термодинамические потенциалы (U. H, G, F). Значения этих функций для элементарного процесса могут быть оценены следующим образом:
 , (5.28)
, (5.28)
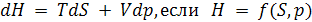 , (5.29)
, (5.29)
 (5.30)
(5.30)
 . (5.31)
. (5.31)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 330; Нарушение авторских прав?; Мы поможем в написании вашей работы!