
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на химическое равновесие
Влияние давления (для реакций, идущих в газовой фазе).
Влияние концентрации реагирующих веществ.
На смещение химического равновесия
Влияние условий проведения реакции
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если оказать на систему какое-либо внешнее воздействие, равновесие нарушается; в системе возникает самопроизвольный процесс, продолжающийся до установления равновесия уже при новых условиях.
Если в равновесную реакционную смесь добавить исходное вещество, начнется самопроизвольный процесс, направленный в сторону его расходования и образования продуктов реакции. Такой же процесс будет протекать, если уменьшить концентрацию продуктов реакции, например, удалять их из реактора.
Давление влияет на положение равновесия только для реакций, протекающих с участием газообразных веществ. Направление смещения равновесия будет определяться знаком Δ n:
– если реакция идет с увеличением объема, т.е. Δn > 0, повышение давления сместит равновесие в сторону исходных веществ, выход продуктов сократится;
– для реакций, протекающих с уменьшением объема (Δn < 0), повышение давления будет способствовать увеличению выхода продуктов реакции.
Влияние давления на равновесные системы, в составе которых нет газов, пренебрежимо мало.
Воспользуемся уравнениями:
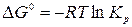 ,
,
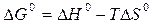 .
.
Совместным решением этих уравнений получим:
 ,
,
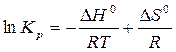 .
.
Полученное выражение продифференцируем по температуре:
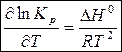 (7)
(7)
Уравнение (7) – уравнение изобары Вант-Гоффа – характеризует влияние температуры на константу химического равновесия.
Анализ уравнения.
Для экзотермических реакций D Н < 0, следовательно,
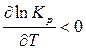 .
.
Это означает, что с повышением температуры константа равновесия экзотермической реакции уменьшается и равновесие смещается в сторону образования исходных веществ. Выход продуктов реакции сокращается.
Для эндотермических реакций D H > 0, следовательно,
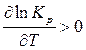 .
.
Это означает, что с повышением температуры константа равновесия эндотермической реакции возрастает и равновесие смещается в сторону увеличения выхода продуктов реакции.
Действие рассмотренных факторов обобщает принцип смещения равновесия, называемый также принципом Ле Шателье – Брауна:
|
|
Дата добавления: 2014-01-20; Просмотров: 547; Нарушение авторских прав?; Мы поможем в написании вашей работы!