
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процессы в растворах
|
|
|
|
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОХИМИЧЕСКИЕ
Методы защиты от коррозии.
| 1.Защитные покрытия | 2. Создание сплавов, стойких к коррозии | 3. Изменение состава среды | 4.Электрохимические методы защиты. |
| а) Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие). б) Покрытие краской, лаками, смазками. в) Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте) | Нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью. | Добавление в среду, окружающую металлическую конструкцию, ингибиторов коррозии (веществ, подавляющих процессы коррозии) | Протекторная защита: присоединение к металлической конструкции пластинок из более активного металла – протекторов. |
Для определения направления и полноты протекания ОВР в водных растворах обычно пользуются значениями электродных потенциалов.
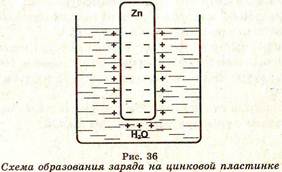
Электродный потенциал (φ) — это разность потенциалов между металлом и раствором его соли, в который он погружен. Наличие электродного потенциала объясняется тем, что при погружении металла в воду под действием полярных молекул воды ионы металла начинают гид- ратироваться и переходить в раствор. При этом металл заряжается отрицательно, поскольку в нём остаются электроны, а раствор — положительно (рис. 36), и между металлом и раствором устанавливается окислительно- восстановительное равновесие:

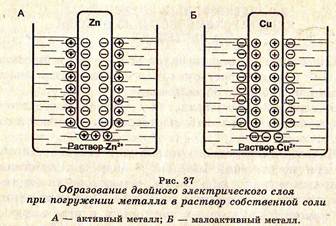
Если металл опускать не в воду, а в раствор его соли, то активные металлы в растворах своих солей заряжаются отрицательно, а неактивные — положительно (рис. 37), на границе раздела металл-раствор образуется двойной электрический слой (Ме0/Мел+) и возникает разность потенциалов между металлом и жидкой фазой (электродный потенциал), который непосредственно измерить невозможно. Поэтому измеряют относительный потенциал в стандартных условиях.
|
|
|
Стандартный электродный потенциал (φ°) металла — это разность потенциалов между металлом, опущенным в раствор его соли с концентрацией 1 моль/л, и нормальным водородным электродом при давлении 101,3 кПа и температуре 298 К (+25°С).
Водородный электрод состоит из рыхлой платиновой пластинки, насыщенной водородом при давлении 101,3 кПа и температуре 298 К и опущенной в 1 М раствор серной кислоты. Потенциал стандартного водородного электрода принят равным нулю при температуре 298 К.
Уравнение Нернста:
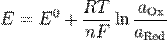 ,
, 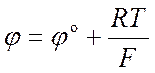 lg[Men+]
lg[Men+] 
где Е – электродный потенциал,
Е0- стандартный электродный потенциал, измеряется в вольтах;
R – универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T – абсолютная температура;
F - постоянная Фарадея, равная 96485,35 Кл·моль−1;
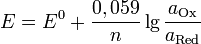
Потенциал окислительно-восстановительного электрода
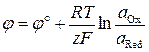 .
.
Например, для системы Fe3+/Fe2+ потенциал
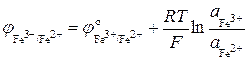 .
.
Физический смысл φ ° делается понятным, когда [Men+] = 1 моль/л. Тогда lg[Men+] = 0 и E = E°. Таким образом, стандартный электродный потенциал (φ°) - это потенциал, возникающий на границе металла с раствором его ионов при концентрации последних 1 моль/л. φ° - это основная характеристика электрода. Уравнение Нернста демонстрирует, что электродный потенциал любого электрода может меняться в очень широких пределах. Это подтверждает член уравнения, который зависит от концентрации ионов металла. Поместим, например, серебряный электрод (φ° = +0,8 В) в раствор кислоты, где концентрация ионов Ag+ составляет 10-15 моль/л. Тогда потенциал электрода уменьшится до φ = 0,8 + 0,06 • lg(10-15) = 0,8 + 0,06 • (-15) = 0,8 - 0,9 = -0,1 В, т. е. поменяет знак, и серебро начнёт вытеснять водород из кислоты! Именно поэтому идёт, в частности, реакция 2Ag + 4HI → 2H[AgI2] + H2. В крепких растворах HI концентрация ионов серебра сильно снижается из-за образования комплексных анионов [AgI2]-.
|
|
|
Самый отрицательный стандартный электродный потенциал у литиевого электрода LiLi+. Это означает, что литий легче других отдает катионы в раствор и заряжается отрицательно. В ряду напряжения повышение электродного потенциала означает усиление окислительных и ослабление восстановительных свойств металлов. Выходит, что самый сильный из всех восстановителей, указанных в ряду, - это литий, а самый слабый - золото.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li+ | -3,05 |
| K | 1e | K+ | -2,925 |
| Rb | 1e | Rb+ | -2,925 |
| Cs | 1e | Cs+ | -2,923 |
| Ba | 2e | Ba2+ | -2,91 |
| Sr | 2e | Sr2+ | -2,89 |
| Ca | 2e | Ca2+ | -2,87 |
| Na | 1e | Na+ | -2,71 |
| Mg | 2e | Mg2+ | -2,36 |
| Al | 3e | Al3+ | -1,66 |
| Mn | 2e | Mn2+ | -1,18 |
| Zn | 2e | Zn2+ | -0,76 |
| Cr | 3e | Cr3+ | -0,74 |
| Fe | 2e | Fe2+ | -0,44 |
| Cd | 2e | Cd2+ | -0,40 |
| Co | 2e | Co2+ | -0,28 |
| Ni | 2e | Ni2+ | -0,25 |
| Sn | 2e | Sn2+ | -0,14 |
| Pb | 2e | Pb2+ | -0,13 |
| Fe | 3e | Fe3+ | -0,04 |
| H2 | 2e | 2H+ | 0,00 |
| Cu | 2e | Cu2+ | 0,34 |
| Cu | 1e | Cu+ | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag+ | 0,80 |
| Hg | 2e | Hg2+ | 0,85 |
| Pt | 2e | Pt2+ | 1,20 |
| Au | 3e | Au3+ | 1,50 |
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 654; Нарушение авторских прав?; Мы поможем в написании вашей работы!