
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакций на основе электронного баланса
|
|
|
|
Методика составления окислительно–восстановительных
Окислительно–восстановительный эквивалент
Типы окислительно-восстановительных реакций.
Важнейшие окислители и восстановители
К числу сильных окислителей, широко используемых на практике, относятся галогены (Fe2, Cl2, Br2, I2), оксид марганца Mn+4O2, перманганат калия KMn+7O4, манганат калия K2Mn+6O4, оксид хрома (хромовый ангидрид) Cr+6O3, хромат калия K2Cr+6O4, бихромат калия K2Cr2+6O7, азотная кислота HN+5O3 и ее соли, кислород О2, озон О3, перекись водорода Н2О2, концентрированная серная кислота Н2S+6О4, оксид меди (II) Сu+2О, оксид серебра Ag2+1O, оксид свинца Рb+4О2, гипохлориты (например, NaCl-1O) и другие соединения.
Щелочные и щелочноземельные металлы являются сильными восстановителями. К числу других восстановителей относятся: водород, углерод, оксид углерода С+2О, сероводород Н2S-2, оксид серы S+4О2, сернистая кислота Н2S+4О3 и ее соли, галогенводороды (кроме HF), хлорид олова (II) Sn+2Cl2, сульфат железа (II) Fe+2SO4.
Различают три типа окислительно–восстановительных реакций: межмолекулярные, внутримолекулярные и реакции самоокисления–самовосстановления.
A. Межмолекулярные – это такие реакции, в которых молекулы, атомы или ионы элементов, входящие в состав одного вещества и являющиеся окислителем, взаимодействуют с молекулами, ионами, атомами, входящих в состав другого вещества (восстановителя): например:
Mn+4O2 + 4HCl-1 = Mn2+Cl2 + Cl20 + 2H2O.
B. Во внутримолекулярных реакциях изменяется СО элементов одного и того же вещества таким образом, что одни из них окисляются, а другие - восстанавливаются. К таким реакциям относится, например, разложение бертолетовой соли и оксида ртути (II):
2KCl+5O3-2 = 2KCl-1 + 3O20;
2Hg+2O-2 = 2Hg0 + O20.
|
|
|
C. В реакциях самоокисления–самовосстановления (диспропорционирования) атомы одного и того же вещества так взаимодействуют друг с другом, что одни отдают электроны (окисляются), а другие их присоединяют (восстанавливаются). Например, растворение хлора в воде:
Cl20 + H2O = HCl+1O + HCl-1 или
(Cl0Cl0 + H2O = HCl+1O + HCl-1).
В обиход химиков, изучающих рассматриваемые процессы, наряду с химическими эквивалентами вошли окислительный и восстановительный эквиваленты. Это частное от деления молярной массы вещества на число приобретаемых (или теряемых) электронов. Так, в реакции
5H2S + 2KMnO4 + 3H3SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
для KMnO4 окислительный эквивалент равен 158,15/5, а для сероводорода восстановительный эквивалент – половине его молярной массы.
С точки зрения электронной теории окислительно–восстановительными реакциями называются такие реакции, при протекании которых происходит переход электронов от одних атомов, молекул или ионов к другим. Поскольку электроны в окислительно–восстановительных реакциях переходят только от восстановителя к окислителю, а молекулы исходных веществ и продуктов реакции электронейтральны, то число электронов, отданных восстановителем всегда равно числу электронов, принятых окислителем. Это положение называется принципом электронного баланса и лежит в основе нахождения коэффициентов в уравнениях окислительно–восстановительных реакций.
Согласно этому принципу число молекул окислителя и число молекул восстановителя в уравнении окислительно-восстановительных реакций должны быть такими, чтобы количество принимаемых и отдаваемых электронов было одинаковым.
Рассмотрим применение принципа электронного баланса при нахождении коэффициентов в уравнениях окислительно–восстановительных реакций на конкретных примерах.
1. При каталитическом окислении аммиака NH3 кислородом О2 образуется оксид азота NO и вода Н2О. Запишем схему процесса с помощью формулы:
|
|
|
NH3 + O2 ® NO + H2O.
Над символами элементов, изменяющих в процессе реакции СО, подпишем их значения:
N-3H3 + O20 ® N+2O-2 + H2O-2.
Из изменения величины СО видно, что азот в молекуле аммиака окислился, а молекула кислорода – восстановилась, то есть аммиак является восстановителем, а кислород – окислителем. Из этой схемы также вытекает, что атом азота, изменяя СО от -3 до +2, отдает кислороду пять электронов. Поскольку водород СО не меняет, то молекула аммиака будет отдавать всего 5 электронов. Атом кислорода принимает 2 электрона (СО меняется от 0 до -2), следовательно, молекула кислорода будет принимать 4 электрона. Запишем указанные процессы в виде схемы:
| N-3 - 5ē ® N+2 5 O20 + 4ē ® 2O-2 4 | 4 окисление – восстановитель 5 восстановление - окислитель |
Согласно принципу электронного баланса количества молекул окислителя и восстановителя нужно взять такими, чтобы числа принимаемых и отдаваемых электронов были равными. Для этого находится общее кратное, а затем делится на число отдаваемых или приобретаемых электронов; полученные коэффициенты ставятся соответственно перед молекулой восстановителя и окислителя. Из этой схемы видно, что 4 молекулы NH3 отдают 20 электронов, которые принимаются 5 молекулами О2. Коэффициенты электронного баланса называются основными коэффициентами. Они никаким изменениям не подлежат:
4NH3 + 5O2 ® NO + H2O.
Все остальное уравнивается в соответствии с их величиной:
4NH3 + 5O2 ® 4NO + 6H2O.
2. При окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются мышьяковистая кислота H3AsO4, серная H2SO4 и оксид азота NO.
Составим схему реакции, указывая СО над символами тех элементов, у которых в процессе реакции они изменяются:
As2+3S3-2 + HN+5O3 ® H3As+5O4 + H2S+6O4 + N+2O.
Подсчитаем количество электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2 электрона. Два атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2 до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3 электрона. Запишем это в виде схемы:
|
|
|
| As2+3S3-2 - 28ē = 2As+5 + 3S+6 (окисление) N+5 + 3ē = N2+ (восстановление) |
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3 (3·28=84) и 28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6H3AsO4 + 9H2SO4 + 28NO.
Подсчет атомов водорода показывает, что в левой части их 28, а в правой – 36. Кислорода в правой части 84 атома, в правой – 88. Если водород или кислород не входят в уравнение реакции в виде простых веществ, то они уравниваются добавлением нужного количества молекул воды в ту часть уравнения, где их недостает. Поэтому подсчет атомов кислорода или водорода проводят в последнюю очередь, причем уравнивание водорода добавлением молекул воды приводит к автоматическому уравниванию кислорода и наоборот. Если водород или кислород входят в уравнение реакции в виде простых веществ, то их необходимо уравнивать независимо друг от друга.
Окончательно рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6H3AsO4+ 9H2SO4 + 28NO.
3. Если числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить основные коэффициенты, например:


| (восстановление) (окисление) |
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3H2S = 4HCl + 3H2SO4.
Электронный баланс в данном случае 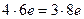 .
.
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то основные коэффициенты удваиваются:
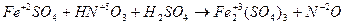

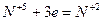
| (окисление) (восстановление) |
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O.
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота. Она необходима для связывания образовавшегося трехвалентного железа. Нужное количество молекул H2SO4 определяется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в последнюю очередь добавлением молекул воды.
|
|
|
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной реакции, расходуется также на связывание образующихся продуктов реакции. Например:
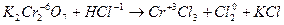
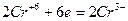

| 3 группы по два иона хлора, всего шесть ионов хлора | (восстановление) (окисление) |
 K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо 8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl). Таким образом:
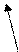
 K2Cr2O7 + 6HCl + 8HCl ® 2CrCl3 + 3Cl2 + 2KCl.
K2Cr2O7 + 6HCl + 8HCl ® 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды H2O, и получим окончательно:
K2Cr2O7 + 14HCl ® 2CrCl3 + 3Cl2 + 2KCl + 7H2O.
6. 
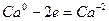
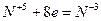
| (окисление) (восстановление) |
Основные коэффициенты 4 и 1:
 4Сa + HNO3 4Ca(NО3)2 + NH4NO3.
4Сa + HNO3 4Ca(NО3)2 + NH4NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9 молекул HNO3:

 4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + NH4NO3 + 3H2O.
4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + NH4NO3 + 3H2O.
на окисление на связывание
7. Оба элемента - и отдающий и принимающий электроны - находятся в одной молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево:

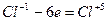 6 6
 4 4
| (окисление) (восстановление) |
Основные коэффициенты 2 и 3 ставятся в правой части уравнения, левая часть уравнивается по правой части:
2KСlO3 = 2KCl + 3O2.
8. Один и тот же элемент окисляется и восстанавливается. Такие реакции называются реакциями диспропорционирования. В этом случае, так же как и в предыдущем, электронный баланс составляется справа налево:
4K2SO3+4 = 3K2SO4+6 + K2S-2
| S+6 + 2ē = S+4 S-2 - 6ē = S+4 | 3 (восстановление) 1 (окисление) |
Рассмотренный способ подбора коэффициентов в окислительно–восстановительных реакциях не является единственным. Существуют и другие способы. Однако во всех случаях главным остается нахождение основных коэффициентов электронного баланса.
Литература:
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. - С. 261-270.
2. Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. - С. 90-106.
3. Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. - С. 14-32.
4. Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С.
5. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. - С. 4-9, 65-75.
* Диэлектрическая проницаемость e характеризует поляризацию диэлектриков под действием электрического поля Е.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 625; Нарушение авторских прав?; Мы поможем в написании вашей работы!