
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водные электролиты
Химически чистая вода является слабым амфотерным электролитом, поэтому ее электролитическая диссоциация выражена слабо (амфотерность – способность химических соединений проявлять основные либо кислотные свойства в зависимости от условий). Вода диссоциирует на катион водорода и анион гидроксила по уравнению:
Н2О «Н+ + ОН- (DН > 0)
Поскольку в воде всегда существует гидратированный протон – ион гидроксония Н3О+, процесс ассоциации воды:
Н2О + Н+ ® Н3О+ (DН < 0).
Итак, вода является неравновесной системой, в которой протекают обратимые реакции.
На основании закона действующих масс константа электролитической диссоциации воды
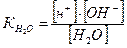
отсюда
[H+] [OH-] = 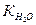 [H2O].
[H2O].
Величина KW= [H+]×[OH-] названа ионным произведением воды. Для чистой воды [H2O] = 1000/18 = 55,6 моль/л (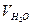 = 1 л = 1000 мл;
= 1 л = 1000 мл; 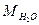 =18 г/моль),
=18 г/моль), 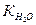 =1,8×10-16. Подставив эти значения получим Кw= [H+]×[OH-]=1,8×10-16×55,6» 10-14.
=1,8×10-16. Подставив эти значения получим Кw= [H+]×[OH-]=1,8×10-16×55,6» 10-14.
Величина KW постоянна для любых концентраций водородных и гидроксильных ионов в растворе электролита при данной температуре. В растворах кислот или щелочей, концентрации водородных и гидроксильных ионов различны, однако, ионное произведение воды остается постоянным при условии неизменности температуры.
С увеличением температуры степень диссоциации воды возрастает, и, следовательно, увеличивается KW. Так, при температуре кипения ионное произведение воды равно ~ 10-12.
Для количественной характеристики кислотных или щелочных свойств водных растворов введена величина, называемая водородным показателем (рН) – это отрицательный десятичный логарифм концентрации ионов Н+:
рН = -lg[H+].
В нейтральном водном растворе при комнатной температуре KW=[H+]×[OH-] = 10-14, откуда [H+] = [OH-] = 10-7 моль/л и рН = 7. В кислых растворах концентрация водородных ионов больше, чем ионов ОН-, [H+]>10-7 моль/л, следовательно, рН<7. В щелочных растворах [H+]< [OH-], [H+] <10-7 моль/л, значит рН >7. Необходимо подчеркнуть, что эти закономерности справедливы только при 25°С.
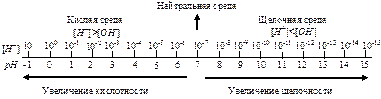
|
|
Дата добавления: 2014-01-13; Просмотров: 859; Нарушение авторских прав?; Мы поможем в написании вашей работы!