
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей 2 страница
|
|
|
|
К комплексным солям близко примыкают двойные соли, например сульфаты – квасцы: KAl(SO4)3·12H2O. Различие между кристаллогидратами, двойными солями и комплексными соединениями заключается в их относительной прочности. Двойные соли при диссоциации распадаются на те ионы, которые находятся в растворах простых солей.
Пример 1. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: а) K[Pt(NH3)Cl3], б) [Al(H2O)6]Cl3, в) Na[Cr(H2O)2(OH)4] г) K2[TaF7].
Решение: Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Степень окисления комплексообразователя определяется так же, как и степень окисления атома в соединении, исходя из того, что сумма степеней окисления всех атомов, входящих в молекулу, равна нулю. Заряды нейтральных молекул (NH3, H2O) равны нулю. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | Степень окисления | К.ч. | |
| а) | -1 | +4 | |
| б) | +3 | +3 | |
| в) | -1 | +3 | |
| г) | -2 | +5 |
Пример 2. Напишите выражение для константы нестойкости комплексного иона [Co(NO2)6]3-.
Решение: Если комплексная соль гексанитрокобальтат (III) натрия, являясь сильным электролитом, в воде необратимо диссоциирует на ионы внешней и внутренней сфер:
Na3[Co(NO2)6] ® 3Na+ + [Co(NO2)6]3-,
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие частицы:
[Co(NO2)6]3- ⇄ Co3+ + 6NO2-.
Константа диссоциации этого процесса называется константой нестойкости (Кн) комплекса:
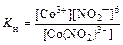 .
.
Чем меньше К н, тем более устойчив данный комплекс.
Пример 3. Сколько моль BaCl2 требуется для осаждения сульфат-ионов из раствора, содержащего 1 моль соли Мора (NH3)2Fe(SO4)2·6 H2O?
|
|
|
Решение: Соль Мора является двойной солью. В растворе она полностью диссоциирует на ионы. Из 1 моль соли образуется 2 моль SO42--ионов, для осаждения которых по реакции 2Ba2+ + 2SO42- = 2BaSO4 требуется 2 моль Ba2+, что соответствует 2 моль BaCl2.
Ответ: 2 моль BaCl2.
Задачи для самостоятельного решения
201. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]Cl2, K2[SiF6], [Pt(NH3)2Cl2], [Al(H2O)5OH]Cl2. Напишите уравнения диссоциации этих соединений в водных растворах.
202. Составьте координационные формулы следующих комплексных соединений хрома: CrCl3·6H2O; CrCl3·5H2O; CrCl3·4H2O. Координационное число хрома равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
203. Можно ли ожидать замещения аммиака во внутренней сфере комплексного иона [Ni(NH3)6]2+ на CN--ионы, если константы нестойкости цианидного и аммиачного комплексов соответственно равны 1·10-22 и 1,86·10-9? Ответ поясните.
204. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Co(NH3)5Cl]Cl2, Na[Sb(OH)6], K2[Ni(CN)4], NH4[Cr(NH3)4Cl2]. Напишите уравнения диссоциации этих соединений в водных растворах.
205. Составьте координационные формулы следующих комплексных соединений ZnCl2·4H2O; Zn(OH)2·2H2O; Zn(CN)2·2KCN. Координационное число цинка равно четырем. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из соединений является неэлектролитом?
206. В какую сторону будет сдвинуто равновесие реакции:
[CuCl2]- + 4CN-⇄ [Cu(CN)4]3- + 2Cl-?
Константы нестойкости комплексных ионов [CuCl2]- и [Cu(CN)4]3- соответственно равны 3 10-6 и 5 10-28? Ответ поясните.
207. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Ni(NH3)6]Cl2, Na2[SnCl6], K2[Cu(OH)4], K[Al(H2O)2(OH)4]. Напишите уравнения диссоциации этих соединений в водных растворах.
|
|
|
208. Составьте координационные формулы следующих комплексных соединений кобальта: CoBr3·4NH3·2H2O; CoBr3·2NH3·3H2O; CoBr3·2NH3·2H2O. Координационное число кобальта(II) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
209. Константы нестойкости комплексных ионов: [Hg(CN)4]2-, [Zn(CN)4]2-, [Cu(CN)4]2- соответственно равны: 4·10-42, 1,3·10-17 и 5·10-32? В каком растворе, содержащем эти ионы, при равной молярной концентрации, CN-- ионов больше? Ответ поясните.
210. Из сочетания частиц Pt4+, Cl-, NH3 и К+ можно составить семь формул комплексных соединений платины, одна из которых [Pt(NH3)6]Cl4. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
211. При добавлении раствора нитрата серебра к раствору, содержащему 0,01 моль соединения состава PtCl4·3NH3, осаждается 0,01 моль AgCl. По результатам этого опыта составьте координационную формулу соединения. Напишите уравнения его диссоциации и выражение для константы нестойкости комплексного иона.
212. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Cr(NH3)6]Cl3, [Cr(NH3)6][Co(CN)6], K3[Co(CN)6]. Напишите уравнения диссоциации этих соединений в водных растворах.
213. Комплекс Ni[Zn(CN)4] зеленого цвета при хранении самопроизвольно переходит в Zn[Ni(CN)4] желтого цвета. Какой комплекс обладает более стабильной внутренней координационной сферой? Ответ поясните, исходя из значений констант нестойкости комплексных ионов, приведенных в заданиях 3 и 9.
214. Медный купорос является кристаллогидратом [Cu(H2O)4]SO4·H2O. На какие частицы он диссоциирует в водном растворе? Сколько граммов хлорида бария необходимо для осаждения сульфат-ионов из раствора, содержащего 0,1 моль купороса?
215. Природный минерал карналлит является двойной солью KCl·MgCl2·6H2O. На какие частицы данная соль диссоциирует в водном растворе? Какое количество (в моль) AgNO3 требуется для осаждения хлора из раствора, содержащего 0,1 моль карналлита?
216. Какое количество NaOH требуется для осаждения Al(OH)3 из раствора, содержащего 0,1 моль двойной соли KAl(SO4)3·12H2O? Напишите молекулярное и ионно-молекулярное уравнения реакций.
217. При выветривании медного купороса [Cu(H2O)4]SO4·H2O в первую очередь удаляется вода из внешней координационной сферы. На сколько граммов уменьшится первоначальная навеска 1 моль купороса при выветривании?
|
|
|
218. Существуют два комплексных соединения кобальта одинакового состава: CoClSO4·5H2O. Раствор одной соли дает осадок с раствором хлорида бария, но не взаимодействует с раствором нитрата серебра. Раствор другой соли дает осадок с нитратом серебра, но не взаимодействует с хлоридом бария. Напишите формулы обоих комплексных соединений. Ответ поясните.
219. Известно, что из раствора комплексной соли CoCl3·6NH3 нитрат серебра осаждает весь хлор, а из раствора CoCl3·5NH3 только 2/3 хлора. Напишите координационные формулы этих солей и уравнения их диссоциации.
220. Может ли образоваться комплексная соль K[Ag(CN)2] при сливании растворов [Ag(NH3)2]Cl и цианида калия, если константы нестойкости ионов [Ag(CN)2]- и [Ag(NH3)2]+ соответственно равны 8·10-21 и 7·10-8? Ответ поясните.
Раздел 12
Химия неметаллов
Деление химических элементов на металлы и неметаллы относительно, тем не менее, оно удобно и поэтому широко используется в практике. Неметаллы расположены в правом верхнем углу периодической системы элементов.
Простые вещества, образованные элементами-неметаллами, не имеют таких физических свойств, как электронная металлическая проводимость, теплопроводность, металлический блеск, ковкость, тягучесть и т.д. Проявление физических неметаллических свойств связано с отсутствием в простых веществах-неметаллах делокализованных электронов. Это, в свою очередь, определяется особенностями электронного строения атомов элементов-неметаллов.
В отличие от металлов изолированные (нейтральные) атомы элементов-неметаллов имеют большое число электронов на внешних электронных оболочках. У типичных неметаллов внешняя электронная оболочка даже у изолированных атомов полностью заполнена (благородные газы) или близка к завершению (галогены, кислород и др.). Известно, что чем ближе электронная оболочка к завершению, тем она прочнее, тем большее энергетическое воздействие требуется для удаления с нее электрона (или электронов) и превращения атома в катион, тем больше склонность таких атомов к присоединению электрона в реакциях восстановления. Отсюда понятно, почему неметаллические свойства проявляют вещества, образованные элементами концов периодов, атомы которых имеют оболочки, близкие к завершению или полностью завершенные.
|
|
|
Радиус изолированных атомов элементов-неметаллов близок к 1 Ǻ. Только инертные газы имеют атомы больших размеров, что объясняется возрастанием межэлектронного отталкивания в полностью сформированных оболочках этих атомов. Таким образом, маленький радиус электронейтральных атомов является также условием проявления простыми веществами неметаллических физических свойств.
Химические проявления неметаллических свойств также определяются большим числом электронов на валентных оболочках изолированных атомов-неметаллов по сравнению с металлами. Они выражаются в стремлении атомов элементов-неметаллов завершить электронную оболочку. В химических реакциях с металлами атомы неметалла перетягивают к себе подвижные электроны металла, завершая свою электронную оболочку и превращаясь в анионы. В реакциях атома-неметалла с неметаллом (с разными или одинаковыми атомами неметаллов) полного переноса электронов с атома одного элемента на другой не происходит из-за близких значений их электроотрицательности. В этом случае завершение электронных оболочек атомов неметаллов происходит за счет образования ковалентных связей (одинарных – F2,, (Cn), (Si)n или кратных – N2, O2, NO3-, ClO4- и т.д.).
Как проявление неметаллических свойств можно рассматривать и склонность ряда элементов-металлов, особенно переходных и «постпереходных» к завершению электронной оболочки за счет ковалентного взаимодействия. В таких случаях могут возникать анионы: MnO4-, MnO42- или комплексные ионы, например, [Co(NH3)6]3+.
Классификация элементов на металлы и неметаллы оставляет в стороне такие элементы как водород и благородные газы.
Водород – особый элемент периодической системы. Он соединяет в себе свойства щелочных металлов и галогенов.
Подобно щелочным металлам водород имеет на наружной оболочке (единственной для него) один электрон (1 s 1), который он способен отдавать, превращаясь в протон. Однако радиус протона (10-5 Ǻ) резко отличается от радиусов ионов щелочных металлов (0,6 – 1,7 Ǻ). В водных растворах ион водорода H+ может существовать только в гидратированном состоянии. Ионы щелочных металлов также окружены гидратными оболочками, однако прочность этих оболочек значительно меньше, чем у протона. Атомный спектр водорода похож на спектры щелочных металлов. Подобно щелочным металлам водород является сильным восстановителем.
Как и галогены, водород – газообразное в обычных условиях вещество, образует двухатомные молекулы с ковалентной связью. Атом водорода проявляет окислительные свойства, присоединяя один электрон и образуя электронную конфигурацию ближайшего к нему атома благородного газа – гелия. Во всех соединениях водорода с металлами анион H- одновалентен, а сами соединения – гидриды – по структуре и характеру связи сходны с галогенидами: являются типичными солями. Благодаря двойственной природе, водороду в периодической системе приписывают два места – в I и VII группах.
Что касается благородных газов, то полностью сформированная электронная оболочка не позволяет отнести их ни к металлам, ни к неметаллам. Они являются элементами, четко разделяющими в естественном ряду элементов металлы и неметаллы. Занимая промежуточное положение, атомы благородных газов должны сочетать в себе свойства металлов и неметаллов. Действительно, наряду с неметаллическими свойствами (агрегатное состояние, низкая электрическая проводимость и др.) отмечаются и признаки металлических свойств, к которым можно отнести реакции, известные для ксенона и криптона, с фтором и кислородом. В них атомы благородных газов выступают как восстановители, подобно металлам.
Несмотря на сильные отличия элементов-неметаллов, можно выделить следующие их наиболее общие свойства:
- Все неметаллы являются р -элементами, имеют не полностью застроенные р -орбитали (однако не каждый р -элемент является неметаллом).
- Все неметаллы характеризуются высоким значением электроотрицательности: для них характерна способность притягивать электроны от других атомов элементов при образовании молекул. Значение электроотрицательности неметаллов изменяется в пределах 2,0 – 4,0.
· Высшие оксиды элементов являются кислотными. Сила соответствующих им кислот увеличивается при переходе от IV к VII группе.
· Водородные соединения неметаллов – газообразные при обычных условиях вещества.
· Соединения неметаллов друг с другом характеризуются ковалентной (неполярной или полярной) связью, тогда как для соединений с металлами типична ионная связь.
Задачи для самостоятельного решения
221. Как получают водород в промышленности и в лаборатории? Приведите уравнения реакций. Как проверить полученный в лаборатории водород на чистоту?
222. Приведите пять уравнений реакций водорода со сложными неорганическими веществами. Укажите условия протекания реакций.
223. В чем проявляется сходство между водородом и галогенами, и в чем различие? Ответ подтвердите примерами.
224. По одному из методов хлор получают окислением хлорид-ионов диоксидом марганца в смеси NaCl, MnO2 и H2SO4. По другому методу сначала из поваренной соли и серной кислоты получают соляную кислоту. Затем соляную кислоту окисляют диоксидом марганца. Если бы в обоих случаях реакция дошла до конца и не было бы потерь NaCl, то при каком методе получится больше хлора и во сколько раз? Составьте уравнения реакций.
225. Как получить хлорную известь, исходя из карбоната кальция, хлорида натрия и воды? Напишите уравнения процессов, которые необходимо для этого осуществить. Какие при этом получаются побочные продукты?
226. На каких свойствах кислорода основан метод получения его из воздуха? В чем заключается принципиальное отличие промышленных и лабораторных способов получения кислорода? Приведите примеры реакций получения О2 в лаборатории.
227. На чем основаны отбеливающие свойства пероксидов? Какие их свойства при этом проявляются: окислителей или восстановителей? Почему при длительном стоянии на солнце пероксид водорода теряет отбеливающие свойства? Ответ подтвердите соответствующими уравнениями реакций.
228. Приведите примеры реакций, в которых сера выступает: а) как окислитель, б) как восстановитель, в) претерпевает самоокисление-самовосстановление.
229. Охарактеризуйте окислительно-восстановительные свойства диоксида серы и сернистой кислоты. Ответ подтвердите примерами.
230. При действии концентрированной серной кислоты на бромиды выделяется SO2, a на иодиды – H2S. Напишите уравнения реакций. Объясните разницу в характере продуктов в каждом случае.
231. Как из воздуха и воды получить соль, применяемую в качестве удобрения. Напишите уравнения реакций. Назовите соединения азота, применяемые в качестве удобрений.
232. Приведите примеры характерных для аммиака реакций присоединения, замещения водорода и окисления.
233. Напишите уравнения реакций получения оксида азота(I), оксида азота(II), оксида азота(IV). Являются ли данные оксиды ангидридами кислот? Почему бурая окраска оксида азота(IV) усиливается при повышении температуры?
234. Приведите уравнения химических реакций, в результате которых из природных веществ получают в настоящее время азотную кислоту.
235. В чем состоят особенности взаимодействия азотной кислоты с металлами? Как изменяется окислительная способность азотной кислоты с разбавлением? Напишите уравнения реакций взаимодействия концентрированной и разбавленной кислоты со следующими металлами: Mg, Fe, Cu.
236. Что называют царской водкой? Чем объясняется ее высокая окислительная способность? Напишите уравнения реакций взаимодействия царской водки с золотом и платиной.
237. Как из природного фосфорита получают фосфорную кислоту и фосфорные удобрения: суперфосфат, двойной суперфосфат, аммофос – смесь моно- и диаммонийфосфатов, преципитата? Напишите уравнения реакций получения.
238. Какие из солей угольной кислоты имеют наибольшее практическое значение? Как получают в промышленности карбонат и гидрокарбонат натрия? Напишите уравнения реакций.
239. Какими реакциями можно получить оксид углерода (IV)? Чем выгоднее пользоваться для поглощения СО2: водой или раствором щелочи? Как можно разделить смесь оксидов СО и СО2? Напишите уравнения реакций.
240. В чем проявляется сходство химических свойств бора и кремния? Укажите не менее четырех признаков сходства и подтвердите их соответствующими уравнениями реакций.
Раздел 13
Химия s -, p -металлов
Большинство химических элементов являются металлами. Элементы-металлы входят в состав всех групп периодической системы. Химические и физические свойства простых веществ, образованных элементами-металлами, имеют ряд особенностей, обусловленных электронным строением атомов металлов.
· Кристаллические решетки металлов являются плотно упакованными структурами.
· Свежеобработанная поверхность металлов всегда имеет характерный блеск.
· Металлы обладают высокой теплопроводностью и электрической проводимостью. При этом наблюдается уменьшение электрической проводимости с ростом температуры.
· Большая часть металлов обладают высокой ковкостью (способностью раскатываться в тонкие пласты) и пластичностью (способностью вытягиваться в проволоку).
· Атомы металлов имеют низкие значения потенциала ионизации. Самым характерным химическим свойством металлов является их способность выступать в качестве восстановителей.
· Особенностью химии металлов является образование интерметаллических соединений при взаимодействии различных металлов друг с другом.
Электропроводность металлов, также как их блеск и теплопроводность, объясняется присутствием в них “свободных” электронов. Если к металлу приложить напряжение, электроны начинают направленно двигаться – возникает электрический ток. С наличием “свободных” электронов связан металлический блеск – происходит рассеяние света электронами. Ковкость металлов также объясняется наличием “свободных” электронов, играющих роль своеобразной “смазки“ – слои металла при ковке как бы скользят по поверхности друг друга.
Все перечисленные свойства, а также склонность элементов-металлов в сложных соединениях выступать в роли катиона определяется малым числом электронов на внешних оболочках изолированных атомов. Так как мало заполненные оболочки неустойчивы, атомы элементов-металлов при образовании соединений стремятся делокализовать свои валентные электроны или передают их на орбитали более электроотрицательных атомов, переходя при этом в катионное состояние.
Основной составляющей химической связи в металлах является так называемая металлическая связь. Согласно простейшей теории металлической связи в металлах происходит обобществление электронов с образованием “электронного газа”, который связывает положительно заряженные плотноупакованные ионы. Теория “электронного газа“ хорошо объясняла электропроводность, блеск, ковкость, пластичность металлов. Однако эта теория не объясняла все свойства металлов, в частности, высокую теплоемкость последних. Ферми и Дираком была предложена зонная теория, согласно которой в твердых телах существуют валентная зона, зона проводимости и запрещенная зона (см. тему «Химическая связь»). В металлах валентная зона и зона проводимости перекрываются или располагаются близко, запрещенная зона отсутствует или очень мала, поэтому при возбуждении электронов переход их в зону проводимости не требует больших затрат энергии.
Особенность химической связи в простых веществах – металлах заключается в отсутствии ковалентной составляющей, которая является главной в простых веществах – неметаллах.
Кристаллическое строение металлов легче объяснить, учитывая ионное взаимодействие положительно заряженных ионов, образовавшихся в результате потери атомами металлов валентных электронов (в связи с переходом их в зону проводимости). Также как у ионов в ионных соединениях (с ненаправленной и ненасыщаемой связью), координационные числа атомов металлов почти во всех типах кристаллических решеток являются большими величинами (8 – 12). Высокими координационными числами объясняется большая механическая и термическая прочность кристаллической структуры большинства металлов: хотя сами по себе связи между атомами в металлах непрочные, но их много.
Существенное влияние на физические и химические свойства металлов оказывают размеры их атомов. Атомы с малым радиусом образуют прочную кристаллическую структуру. Наоборот, металлы с большими радиусами атомов чаще всего химически и термически более активны (например, щелочные металлы, барий и др.).
Все металлы в соответствии с электронным строением их валентного уровня делят на s -, p -, d -, f -металлы.
К s -металлам относятся элементы, у которых происходит заполнение наружного s -подуровня. Это элементы главных подгрупп I и II групп периодической системы. Они обладают самой высокой восстановительной способностью по сравнению с другими металлами.
Металлы, составляющие главную подгруппу I группы: Li, Na, K, Rb, Cs, Fr называются щелочными. При движении вниз по группе (от Li к Fr) возрастают ионный и атомный радиусы элементов, увеличивается плотность металлов, понижаются температуры плавления и кипения простых веществ, снижаются значения потенциала ионизации и электроотрицательности. Эти изменения в большинстве случаев связаны с увеличением числа электронных слоев в атомах элементов.
Для всех щелочных металлов характерна постоянная степень окисления + 1.
Щелочные металлы исключительно активны. Они сгорают на воздухе или в кислороде, при этом состав образующихся продуктов зависит от природы металла. Так, литий образует оксид Li2O, натрий – пероксид Na2O, калий, рубидий и цезий – супероксиды (надпероксиды) KO2, RbO2, CsO2. Пероксиды и надпероксиды - исключительно сильные окислители. Литий в ряду щелочных металлов имеет наименьший по размеру катион. В химии лития проявляется его диагональное сходство с магнием – об этом свидетельствует низкая растворимость соединений: Li2CO3, LiF, Li3PO4, LiOH.
Все щелочные металлы энергично взаимодействуют с водой, выделяя водород, т. е. окисляются ионами водорода:
2Ме0 + 2Н2О → 2Ме+ +ОН - + Н2↑.
Гидроксиды щелочных металлов (щелочи) в промышленности обычно получают электролизом водных растворов соответствующих хлоридов. Гидроксиды щелочных металлов являются ионными соединениями и не отщепляют воду даже при нагревании до температур кипения. Исключение составляет гидроксид лития, который начинает терять воду уже при температуре 600 °С. Растворы щелочей являются сильными электролитами.
Щелочные металлы энергично взаимодействуют с галогенами, серой и водородом. Их гидриды МеН – типичные солеобразные соединения с ионной связью. Они устойчивы на воздухе в отсутствии влаги, но разлагаются водой:
МеН + Н2О = МеОН + Н2↑.
В главную подгруппу II группы входят следующие s -элементы: бериллий, магний, кальций, стронций, барий и радий. С увеличением атомного номера у этих элементов, также как и у щелочных металлов, возрастают атомный и ионный радиусы, увеличивается плотность, снижаются значения потенциала ионизации и электроотрицательности. Все эти элементы проявляют в своих соединениях степень окисления +2. Реакционная способность их довольно высока, хотя значительно уступает щелочным металлам. На воздухе металлы II группы покрываются пленкой, которая наряду с оксидами содержит пероксиды и нитриды. Оксиды МеО имеют менее выраженные основные свойства, чем оксиды щелочных металлов. Растворимость и активность их возрастает по подгруппе с возрастанием атомного номера. Стремление к образованию высших кислородных соединений также выражено менее ярко, чем у щелочных металлов.
Взаимодействие с водой характерно для всех металлов подгруппы, исключая бериллий:
Ме0 + 2Н2О → Ме(ОН)2 + Н2↑.
Слабое протекание этой реакции для магния обусловлено низкой растворимостью его гидроксида в воде и образованием защитной пленки на поверхности. Гидроксиды Ме(ОН)2 – более слабые основания, чем гидроксиды щелочных металлов, и хуже растворимы в воде. Сила их растет при переходе от Ве(ОН)2 к Ba(OH)2.
Магний и щелочноземельные металлы при нагревании реагируют с водородом, образуя солеобразные гидриды. Галогениды, карбиды, сульфиды и нитриды также можно получать прямым синтезом.
К числу р -металлов относятся элементы главных подгрупп III (Al, Ga, In, Tl), IV (Ge, Sn, Pb), V (Sb, Bi) и VI (Po) групп. У всех этих элементов металлические свойства выражены слабее, чем у щелочных или щелочноземельных металлов. Принадлежность к различным группам периодической системы
Д. И. Менделеева обусловливает различные значения степеней окисления у р -металлов.
Для алюминия и его аналогов по подгруппе высшая степень окисления равна +3. Она наиболее характерна для всех элементов III группы, за исключением таллия. Для таллия наиболее устойчивой является степень окисления +1. Соединения Tl(I) проявляют большое сходство с соответствующими соединениями щелочных металлов.
Высшая степень окисления у германия и его аналогов по подгруппе +4. Однако при переходе к олову и далее к свинцу возрастает стабильность соединений со степенью окисления + 2.
Физические свойства р -металлов очень разнообразны. Например, температура плавления галлия 30°С, а у находящихся рядом с ним в периодической системе алюминия и германия соответственно 660 и 937 °С.
Среди р -металлов III – VI групп самыми активными по отношению к кислороду воздуха являются таллий и свинец. Они покрываются серой пленкой оксидов уже при комнатной температуре. Защитная оксидная пленка образуется на поверхности некоторых других р -металлов, например алюминия.
При нагревании алюминий и его аналоги по подгруппе энергично взаимодействуют с кислородом. Высшим оксидам этих элементов соответствуют гидроксиды Ме(ОН)3, проявляющие амфотерные свойства. Так, гидроксид алюминия в растворе очень слабо диссоциирует следующим образом:
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1483; Нарушение авторских прав?; Мы поможем в написании вашей работы!