
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 18. Гальванический элемент
|
|
|
|
Элемент Даниэля - Якоби
ЭДС гальванического элемента
Zn│Zn2+││ Cu2+│Cu

В отсутствии тока (разомкнутая цепь) Þ
на границе Ме-раствор равновесие:
Zn  Zn2+ + 2e-
Zn2+ + 2e- 
Cu  Cu2+ + 2e-
Cu2+ + 2e- 

ЕЭ –электродвижущая сила ГЭ (ЭДС) – разность равновесных электродных потенциалов катода и анода
 - стандартная ЭДС ГЭ
- стандартная ЭДС ГЭ
(активности потенциалобразующих ионов =1 моль/л)
При замыкании цепи Þ равновесие нарушается: во внешней цепи возникает самопроизвольное направленное движение e- от А к К.
Е 0Cu2+/Cu = 0,337 B; Е 0Zn2+/Zn = -0,763 B
ЕЭ = (ЕК – ЕА) > 0 Þ ЕК > ЕА Þ
А (-) – анод: Zn0 ® Zn2+ + 2 e-
окисление (растворение)
К (+) – катод: Cu2+ + 2 e- ® Cu0
восстановление (осаждение)
Суммарная реакция, протекающая в ГЭ – токообразующая реакция:
Zn0 + Cu2+ + 2 e-  Cu0 + Zn2++2 e- (ТОР)
Cu0 + Zn2++2 e- (ТОР)
Е 0Э = Е 0Cu2+/Cu – Е 0Zn2+/Zn = 0,337 – (-0,763) = 1,1 B


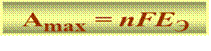
 В обратимом процессе (р,Т = cоnst):
В обратимом процессе (р,Т = cоnst):
nF – количество электричества, прошедшее через цепь;
ЕЭ – ЭДС;
n – число моль e-.
 Þ
Þ
EЭ = -D GТОР /(nF)
Для ТОР, протекающей в растворе
а А(р) + b В(т) Û d D(р) + l L(г)
изотерма Вант - Гоффа:
D G ТОР = D G0 ТОР + RTln  (: - nF), имеем
(: - nF), имеем
Е Э = -
Связь ЭДС с константой равновесия ТОР
D G0 ТОР = - RTlnKa ≈ - RTlnKс Þ

R – универсальная газовая постоянная, 8,31Дж/моль.К;
n – число e-, принимающих участие в реакции
F – число Фарадея, ≈ 96500 Кл/моль;
T – температура, К.
При расчетах обычно принимают ai ≈ ci
При стандартных состояниях реагентов:
а А = а D = 1 моль/л, р L = 1 атм (≈ 105 Па)
E0Э = -D G0ТОР /(nF)
Уравнение Нернста для расчета ЭДС ГЭ при нестандартных состояниях компонентов:
 уравнение Нернста
уравнение Нернста
В общем случае:
Ox + n e  Red
Red
окисленная восстановленная
формы вещества
 -
-
Если потенциал одного из электродов принять = 0, то относительный потенциал другого электрода буден = Е э Þ
|
|
|

- уравнение Нернста
для расчета равновесного потенциала электрода
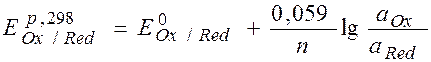
0,059 В = 
Абсолютного значения электродного потенциала определить нельзя
За 0 потенциала (при любой Т) принят потенциал стандартного водородного электрода 
Для измерения Еравн любого электрода составляют электрохимическую цепь из данного и стандартного водородного электродов, причем последний всегда считают анодом.
Ер = 
ПОТЕНЦИАЛЫ ГАЗОВЫХ И МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ
СТАНДАРТНЫЙ ВОДОРОДНЫЙ ЭЛЕКТРОД

Pt/Pt – платинированная Pt
электролит: Н2SO4
Если:
р (Н2) = 1 атм = 105 Па,
рН = 0, а Н+ = 1 моль/л
Е0 Н+ /Н2 = 0
1. Адсорбция Н2 на Pt/Pt
2. Pt (Au, Pd) не принимает участия в электродной реакции (↑ Е ион)
3. Потенциалопределяющая реакция на границе Pt/Pt, адс. Н2 - раствор:
2Н+(р – р) + 2 е -  Н2 (газ)
Н2 (газ)
окисл. форма восстановл. форма
Уравнения Нернста для расчета нестандартных значений 



Чем ↑ Р Н2, и ↑рН, тем более отрицательные значения принимает 
КИСЛОРОДНЫЙ ЭЛЕКТРОД
Реализуется аналогично водородному электроду.
Pt/Pt – платинированная Pt, электролит: КOН
Если:
р (О2) = 1 атм = 105 Па, рН = 14, а ОН- = 1 моль/л Þ
Е0 О2/ОН- = 0,401 В (отн. стандартного водородного электрода)
Потенциалопределяющая реакция на границе Pt/Pt, адс. О2 - раствор:
О2 (газ) + 2 Н2О + 4 е -  4ОН-(р – р)
4ОН-(р – р)
окисл. форма восстановл. форма

Уравнения Нернста для расчета нестандартных значений
 a H2O = const, a OH- = 10-14/ a H+ Þ
a H2O = const, a OH- = 10-14/ a H+ Þ


Зависимость Ер водородного и кислородного электродов от рН отражает диаграмма Пурбе

МЕТАЛЛИЧЕСКИЕ ЭЛЕКТРОДЫ
Уравнение Нернста для металлических электродов.
Потенциалопределяющая реакция:
M(р-р) n + + n e  M(т)
M(т)
аM = const = 1

При Т = 298 К и переходе к десятичному логарифму:
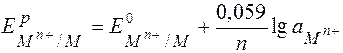
Для измерения ЕрМn+/М по водородной шкале собирают ГЭ:
Н2, Pt │H+││M n +│M
измеряют его ЭДС:
ü компенсационным методом с помощью переменной внешней ЭДС
|
|
|
ü высокоомным вольтметром

|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1337; Нарушение авторских прав?; Мы поможем в написании вашей работы!