
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественное определение. Natrium thiosulfuricum
|
|
|
|
Подлинность.
Натрия тиосульфат
Natrii thiosulfas
Natrium thiosulfuricum
Natrium hyposulfuricum
Натрия гипосульфит
Na2S2O3·5H2O
| М.м. 248,18 |
В природе не встречается, получают синтетически – сульфитным методом.
Na2SO3 + S = Na2S2O3
Описание. Бесцветные прозрачные кристаллы без запаха, солоновато горького вкуса. В теплом сухом воздухе выветривается, во влажном воздухе слегка расплывается. При температуре около 500С плавится в кристаллизационной воде.
Растворимость. Очень легко растворим в воде, практически нерастворим в спирте.
1) Препарат дает характерные реакции на ион натрия.
2) На тиосульфат-ион с раствором соляной кислоты. Препарат растворяют в воде, прибавляют несколько капель соляной кислоты; через некоторое время раствор мутнеет, вследствие выделения серы (отличие от солей сернистой кислоты), с одновременным образованием сернистой кислоты, обнаруживаемой по запаху.
Na2S2O3 + 2HCl = 2NaCl + S↓ + SO2↑ + H2O
3) C избытком раствора нитрата серебра белый осадок, быстро переходящий в желтый, бурый и, наконец, черный.
Na2S2O3 + 2AgNO3 = Ag2S2O3↓ + 2NaNO3
Ag2S2O3 → Ag2SO3 + S↓
Ag2SO3 + S + H2O → Ag2S↓ + H2SO4
Йодометрический метод.
Точную навеску препарата растворяют в воде и титруют 0,1М раствором йода (индикатор - крахмал).
2Na2S2O3 + J2 = Na2S4O6 + 2NaJ
| 2S2O32- -2e | → | S4O62- | ||
| J2 + 2e | → | 2J- |
УЧ = 1
Формула прямого титрования
Метод основан на способности восстанавливать J2 до J-, а сам препарат окисляется до тетратионата натрия.
Хранение. В хорошо укупоренной таре.
Применение. Основано на способности препарата выделять серу. Применяется при отравлении цианидами, галогенами, синильной кислотой, препаратами мышьяка, ртути, свинца (образуются неядовитые сульфиды).
|
|
|
KCN + Na2S2O3 = KSCN + Na2SO3
Роданид менее токсичен, чем цианид.
Наружно применяют как инсектицидное средство.
Пропись Демьяновича состоит из двух растворов:
1) Раствора тиосульфата натрия 60% - 100 мл;
2) Раствора соляной кислоты 6% - 100 мл.
Тусл NaOH/HCl = 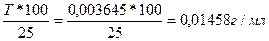
Na2S2O3 + 2HCl = 2NaCl + S↓ + SO2↑ + H2O
Образуется мелкодисперсная сера, обладающая высоким противопаразитарным действием. SO2 прекращает зуд и уничтожает действие чесоточного клеща. Также применяется при аллергических заболеваниях, артритах, невралгиях (30% раствор внутривенно).
См. Учебно-методическое пособие по внутриаптечному контролю: раствор натрия тиосульфата 60% для наружного применения.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3724; Нарушение авторских прав?; Мы поможем в написании вашей работы!