
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые способы получения этиленовых углеводородов
| Название реакции | Примеры |
| 1. Крекинг алканов и пиролиз нефти 2. Дегидрогенизация алканов 3. Дегидратация спиртов 4. Дегидрогалогенирование |  →СН3 – СН3 + СН2=СН2 →СН3 – СН3 + СН2=СН2
 С4Н10
→СН2=СН – СН3 + СН4
С4Н10 С4Н10
→СН2=СН – СН3 + СН4
С4Н10 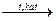 СН2=СН – СН2 – СН3
(СН3 – СН=СН – СН3) + Н2 СН2=СН – СН2 – СН3
(СН3 – СН=СН – СН3) + Н2 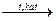 СН2=СН – СН=СН2 + Н2
СН3СН2ОН СН2=СН – СН=СН2 + Н2
СН3СН2ОН 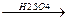 СН2=СН2 + Н2О
СН3СН2Сl + KOH(спирт.р-р) →
CH2=CH2 + KCl + H2O СН2=СН2 + Н2О
СН3СН2Сl + KOH(спирт.р-р) →
CH2=CH2 + KCl + H2O
|
Для этиленовых углеводородов характерны реакции электрофильного присоединения (АЕ), которые протекают через две основные стадии:
Присоединение положительно заряженной частицы с промежуточным образованием катиона с положительным зарядом на атоме углерода (карбкатион):
+
>C=C< + A│:B → >C – C<
│
A
стабилизации карбкатиона за счёт присоединения аниона с образованием нейтральной молекулы:
+
>С – С < + В- → >C – C<
│ │ │
A B A
По такому механизму протекает реакция присоединения молекул галогена, воды и галогеноводородов.
В случае реакций несимметричных этиленовых углеводородов присоединение на первой стадии положительно заряженной частицы протекает таким образом, что промежуточно образуется самый устойчивый карбкатион, т.е. карбкатион, в котором положительный заряд максимально равномерно распределен по всей частице, например:
СН3СН=СН2 + HCl → CH3CHClCH3
Реакция протекает по правилу Марковникова: при ионном присоединении к несимметричным алкенам водород присоединяется по месту двойной связи к наиболее, а галоген – к наименее гидрогенизированному атому углерода. Поскольку из двух
+ +
возможных карбкатионов СН3СНСН3 (1) и СН3СН2СН2 (2) вторичный карбкатион (1) более стабилен по сравнению с карбкатионом (2) в результате большего погашения положительного заряда на атоме углерода за счёт двух СН3-групп, то реакция идет именно в данном направлении.
В общем, стабильность карбкатионов соответствует ряду:
Третичные > вторичные > первичные
+ + +
R3 – C R2 – CH R – CH2
Таблица 6
|
|
Дата добавления: 2014-11-25; Просмотров: 444; Нарушение авторских прав?; Мы поможем в написании вашей работы!