
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Моногалогенопохідні насичених вуглеводнів або галогеналкіли
|
|
|
|
Конспект лекційного заняття
План лекційного заняття
Основні поняття
Аліфатичні аміни.
ГАЛОГЕНО-, нітро-, сульфоПОХІДНІ ВУГЛЕВОДНІВ.
ЛЕКЦІЯ №7
Галогени,нітропохідні,сульфопохідні, вуглеводи, аміни.
1. Галогенопохідні вуглеводнів
2. Нітропохідні вуглеводнів
3. Сульфопохідні вуглеводнів
4. Аліфатичні аміни
Література
1. Ластухін Ю.О., Воронов С.А. Органічна хімія. – Львів: Центр Європи, 2001. – С. 71-127, 190-200.
2. Нейланд О.Я. Органическая химия. – М.: Высшая школа, 1990. – С. 9-13, 22-38, 59-61, 81-85, 86-89, 92-95, 103-105, 130, 145, 177-179, 225-228.
3. Перекалин В.В., Зонис С.А. Органическая химия. – М.: Просвещение, 1972. – С. 6-17, 18-25, 29-38, 47-48, 54-58, 76, 78-79, 105, 160-161, 177-179.
4. Петров А.А., Бальян Х.В., Трощенко А.Б. Органическая химия. – М.: Высшая школа, 1973. – С. 5-11, 20-43, 44-48, 64-65, 248-257.
5. Чирва В.Я., Ярмолюк С.М., Толкачова Н.В., Земляков О.Є. Органічна хімія. – Львів: БаК, 2009. – С. 81-131.
Галогенопохідні насичених вуглеводнів можна розглядати як похідні насичених вуглеводнів, у яких один або кілька атомів гідрогену заміщені атомами галогену. В залежності від заміщення галогенами одного, двох, трьох і т.д. атомів гідрогену розрізняють: моногалогенопохідні, дигалогенопохідні, тригалогенопохідні і полігалогенопохідні.
Введення одного або кількох атомів галогену в молекулу вуглеводню надає цій молекулі підвищеної реакційної здатності; заміщуючи далі галоген іншими атомами або групами атомів, наприклад ОН, CN, NO2, NH2 та ін., можна добути багато речовин, синтез яких безпосередньо з вуглеводнів ускладнений або взагалі неможливий.
Галогенопохідні вуглеводнів широко застосовуються як розчинники, інсектициди, холодоагенти і т. ін. Ще більше значення вони мають як проміжні продукти у виробництві каучукоподібних матеріалів, пластичних мас, спиртів та ін.
|
|
|
Галоген може заміщувати гідроген у різних карбонових атомах в ланцюгу. Якщо галоген стоїть біля карбону, зв’язаного з одним карбоновим атомом, галогенопохідне називається первинним галогенним алкілом; якщо галоген стоїть біля карбону, зв’язаного з двома карбоновими атомами, галогенопохідне називається вторинним, і, нарешті, якщо галоген стоїть біля карбону, зв’язаного з трьома карбоновими атомами, галогенопохідне називається третинним, наприклад:
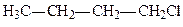
| 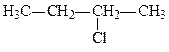
| 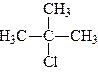
|
| первинний 1-хлорбутан | вторинний 2-хлорбутан | третинний 2-метил, 2-хлорпропан |
Із цих прикладів видно, що ізомерія моногалогенопохідних насичених вуглеводнів залежить від ізомерії карбонового ланцюга та від положення галогенів.
Номенклатура. Назви моногалогенопохідних за раціональною номенклатурою складають з назв радикалу з додаванням слів фтористий, хлористий, бромистий, йодистий, наприклад: СН3F – фтористий метил, СН3СН2Сl – хлористий етил, СН3СН2СН2Вг – бромистий пропіл, (СН3)2CHJ – йодистий ізопропіл, тобто комбінуючи назву алкільного радикала з назвою аніона галогену (незважаючи на те, що сполука є, безсумнівно, ковалентною).
За женевською номенклатурою назви моногалогенопохідних насичених вуглеводнів утворюють від назв відповідних вуглеводнів, при цьому спочатку ставиться цифра, що вказує, біля якого карбонового атома стоїть галоген, потім назва галогену і вуглеводню, наприклад:
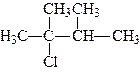
| 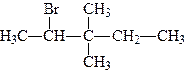
|
| 2-хлор-2,3-диметилбутан | 2-бром-3,3-диметилпентан |
іЗОМЕРІЯ. Галогенопохідним алканам властива структурна ізомерія, зумовлена будовою (розгалуженням) карбонового ланцюга і положенням атома галогену у ланцюзі, а також конфірмаційна ізомерія (див. алкани).
Способи добування. Галогеналкіли можна добути кількома способами.
1. Дія галогенів на насичені вуглеводні при світлі або у присутності каталізаторів (Fe, CuCl2, АlСl3 та ін.). При цьому можна добути моно-, ди-, три- і полігалогенопохідні:
|
|
|
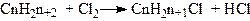 ,
,
 ,
,
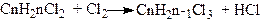 ,
,
 .
.
З галогенів найбільш енергійно діє флуор, потім хлор, слабкіше – бром і найслабкіше – йод.
Галогенуванням насичених вуглеводнів не можна добути індивідуальне галогенопохідне в чистому вигляді. Практично це буде суміш галогенопохідних. У промисловості застосовують тільки хлорування і фторування насичених вуглеводнів; бромування і йодування їх у промисловому масштабі не проводиться.
2. Приєднання галогеноводнів до етиленових вуглеводнів яке відбувається за правилом В.В. Марковникова:
 .
.
3. Заміщення в спиртах гідроксильної групи галогеном. Це заміщення найлегше відбувається при дії на спирт галогеноводнів або галоїдних сполук фосфору.
а) Дія на спирт галогеноводнів
 .
.
Ця реакція відбувається у дві стадії. Первісне протонування гідроксильної групи під дією галогеноводню призводить до утворення йона оксонія. На другій стадії йон оксонія піддається нуклеофільній атаці аніоном галогена (див. нижче), у результаті чого відбувається елімінування води й утворюється алкілгалогенід:
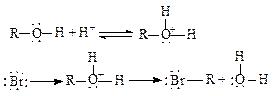
Хлороводень, як правило, реагує зі спиртом дуже повільно, бромоводень і йодоводень легко перетворюють спирти у відповідні галогеніди. Фтороводень в аналогічну реакцію зі спиртами не вступає. Із спиртів найлегше вступають у реакцію третинні, гірше вторинні і ще гірше – первинні.
Галоген, сполучений з атомом карбону є слабкою основою. Його у вигляді йона можна легко замінити на сильнішу основу, тобто на іншу нуклеофільну частинку. Тому для галогеналканів характерними є реакції нуклеофільного заміщення (SN-реакції). При нуклеофільному заміщенні нуклеофіл атакує молекулу і надає для утворення нового зв’язку свої електрони. Електрони зв’язку, який розривається, відходять разом з йоном, який при цьому утворився.
Нуклеофільним реагентом Z– можуть бути йони ОH–, OR–, CN–, RCOO–, SH–, SCN–, NO2– тощо, а також нейтральні молекули які мають вільну пару електронів.
Механізм реакції утворення галоїдних алкілів із спиртів і галогеноводнів обумовлено, як показує кінетичне дослідження, характером алкілу. Для первинних алкілів реакція відбувається за бімолекулярним механізмом, а для вторинних і третинних алкілів – молекулярним. Причому перша та третя стадії відбуваються швидко, а друга повільно:
|
|
|
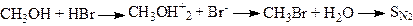 ,
,
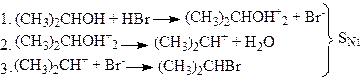
б) Дія на спирт галоїдних сполук фосфору і сірки
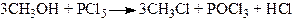 .
.
Для проведення цієї реакції часто замість готових галогенних сполук беруть фосфор і галогени, які при взаємодії утворюють галоїдні сполуки фосфору.
Фізичні властивості. Фізичні властивості моногалогенопохідних насичених вуглеводнів залежать від вуглеводневого радикала і природи галогену. При збільшенні кількості карбонових атомів у карбоновому ланцюзі зменшується питома вага і підвищується температура кипіння. З ізомерних сполук найбільш високу температуру кипіння мають нормальні первинні, нижчу – вторинні і найбільш низьку – третинні сполуки. При переході від хлорпохідних до бром- і йод похідних питома маса і температура їх кипіння підвищується. Галогеналкіли безбарвні, майже нерозчинні у воді, але добре розчинні у спирті і ефірі. Нижчі гомологи похідних хлору і брому мають характерний запах і при внесенні в полум’я пальника на мідному дроті забарвлюють його по краях в зелений колір (проба Бельштейна на галогени).
Хімічні властивості. Галогеналкіли є реакційно здатними органічними сполуками внаслідок наявності полярного зв’язку між атомом карбону і галогеном. Вони легко заміщують атом галогену найрізноманітнішими радикалами. Звичайно в галогеналкілах йод більш рухомий, ніж бром, а останній рухоміший хлору.
А. Реакції нуклеофільного заміщення. Найбільш важливими реакціями алкілгалогенідів є ті, у яких атом галогену заміщується на інший атом або групу. Відомо чимало реакцій подібного типу, кожна з яких може бути прикладом здійснення одного з наступних процесів:
-Y: + R–X ® Y–R +:X- ; Z: + R–X ® Z+–R +:X-
де R – алкільна група, X – галоген, a Y- і Z – нуклеофільні агенти. Всі реакції, перераховані нижче, відносяться до зазначеного типу. Слід зазначити, що катіон, зв'язаний з аніоном Y-, не здійснює відчутного впливу на напрямок реакції, наприклад гідроксиди літію, натрію, калію, магнію, кальцію або барію однаковою мірою ефективні в перетворенні алкілгалогенідів у відповідні спирти.
|
|
|
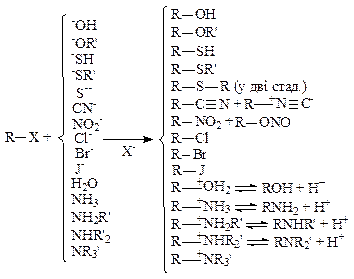
Перераховані вище реакції здійснюються за одним із двох механізмів. Висока електронегативність атома галогену обумовлює поляризацію зв'язку С–X в алкілгалогеніді, у результаті чого на атомі карбону виникає частковий позитивний заряд. Нуклеофільний агент, який володіє вільною парою електронів, може віддати електрони позитивно зарядженому карбоновому атому. Однак, оскільки атом карбону обмежений максимальною ковалентністю 4, то будь-яке надання йому електронів повинно викликати відповідне переміщення електронної густини у зв'язку С–X у напрямку до атома галогену. Таким чином, одночасно відбуваються атака нуклеофілу на атом карбону з утворенням нового ковалентного зв'язку й відхід атома галогену у вигляді аніона. Оскільки взаємодія нуклеофілу Y- і атома карбону найбільше вигідна за умови, коли Y-, С і X лежать на одній прямій, то нуклеофіл повинен наближатися до алкілгалогеніду з боку, протилежному тому, від якого в остаточному підсумку відщепиться аніон Х-:
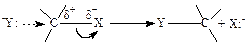
Цей механізм відомий як “бімолекулярне нуклеофільне заміщення і позначається SN2. Важливий аспект механізму SN2, пов'язаний з тим, що в процесі нуклеофільного заміщення відбувається обертання пірамідального оточення карбонового атома трьома зв'язаними з ним групами (див. наведену нижче схему).
Альтернативний механізм діє в тому випадку, коли карбоновий атом, зв'язаний з атомом галогену, містить ще три алкільні групи, наприклад (СН3)3С–Cl. У розглянутому прикладі об'ємні алкільні замісники перешкоджають близькому підходу нуклеофілу до електронодефіцитного карбонового атома. У таких випадках реакція протікає у дві стадії.
На першій стадії відбувається повільна іонізація алкілгалогеніду з утворенням карбкатіону й аніона галогену. На другій стадії відбувається дуже швидка взаємодія нуклеофілу з карбкатіоном, що й призводить до утворення продукту нуклеофільного заміщення. Варто відмітити, що високозаміщені карбкатіони, які утворюються при здійсненні нуклеофільного заміщення у дві стадії, це саме ті катіони, які в принципі найбільше легко утворюються. Описуваний механізм відомий як “мономолекулярне нуклеофільне заміщення (SN1):
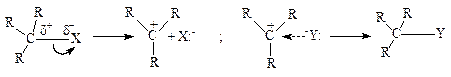
Просторовий аспект цього механізму, істотно відрізняється від відповідних закономірностей механізму SN2.
У реакціях нуклеофільного заміщення не обов'язково повинен відщеплюватися аніон галогену. Деякі інші електронегативні групи, які при гетеролітичному розщепленні зв'язку з карбоном утворюють стабільну молекулу або іон, також можуть відігравати роль групи, яка відщеплюється. Приклад реакції подібного типу був наведений раніше при розгляді методу одержання алкілгалогенідів зі спиртів. Йон оксонію (R–О+Н2), який утворився при протонуванні піддавався типовій нуклеофільній атаці галогенід-йоном, у результаті чого відбувалося елімінування води й утворення алкілгалогеніду (група, що відщеплювалася – молекула води).
1. Реакція з йодистим воднем. При взаємодії галогенопохідних з йодистим воднем атом галогену заміщується воднем:
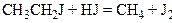
2. Гідроліз. При дії гідрату оксиду срібла або води (особливо за наявності лугів) на галогеналкіли утворюються спирти:
 .
.
3. Реакція з аміаком (амоноліз). Галогеналкіли, взаємодіючи з аміаком, утворюють аміни:
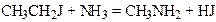 .
.
4. Реакція з алкоголятами. При взаємодії галогеналкілів з алкоголятами утворюються прості ефіри (синтез Вільямсона):
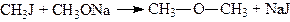 .
.
5. Утворення складних ефірів. З солями органічних кислот галогеналкіли утворюють складні ефіри:
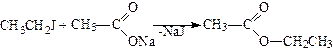 .
.
6. Реакція з солями синільної кислоти. При дії на галогеналкіли солями синільної кислоти утворюються ціанисті сполуки:
 .
.
7. Реакція з солями сірководню. При взаємодії галогеналкілів з солями сірководню утворюють тіоспирти, або тіоефіри:
 .
.
8. Взаємодія з металами: а) При дії на галогеналкіли металічного натрію добувають насичені вуглеводні з великою кількістю атомів вуглецю (реакція Вюрца):
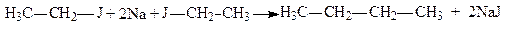 .
.
б) При взаємодії галогеноалкілів з магнієм в присутності безводного діетилового ефіру утворюються магнійорганічні сполуки (реакція Гріньяра):
 .
.
9. Відщеплення галогеноводню. При нагріванні галогеналкілів з спиртовими розчинами їдких лугів утворюються етиленові вуглеводні:
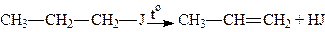 .
.
Існує емпіричне правило, що визначає переважний напрям реакцій відщеплення. При відщепленні галогеноводнів від галогеналкілів водень відщеплюється від найменш гідрогенізованого атома вуглецю (правило Зайцева). Наприклад:
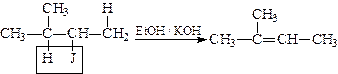 .
.
Теоретично правило Зайцева можна тлумачити таким чином. У випадку реакції відщеплення галогеноводнів, наприклад з сполуки R–СН2–СНJ–СН3, можуть утворюватися два види алкенів:
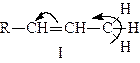
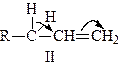
Через те що алкен І більш стабілізований спряженням Н–С і С=С зв’язків, ніж алкен II (в алкені І з подвійним зв’язком спряжені мінімум три, а в алкені II – лише два С–Н зв’язки), він має менший запас енергії. Таким чином, більш вигідна реакція утворення алкену І буде проходити термодинамічно.
Галогеналкіли застосовуються як алкілюючі засоби для введення одновалентних радикалів аліфатичного ряду (–СН3, –C2Н5 і т.д.) у різні хімічні сполуки.
Хлористий метил СН3Сl добувають у промисловості хлоруванням метану при 400–500°С в присутності каталізатора (хлориди металів, які осаджені на пемзі). Хлористий метил застосовується в промисловості органічного синтезу як метилюючий засіб. Крім того, він використовується як холодоагент у холодильних установках.
Йодистий метил CH3J одержують дією йоду та червоного фосфору на метиловий спирт. Він широко використовується для синтезу органічних речовин.
Хлористий етил С2Н5Сl – безбарвна рідина з приємним запахом. Основним способом одержання хлористого етилу є гідрохлорування етилену при температурі –15° в присутності каталізатора хлористого алюмінію. Хлористий етил одержують також хлоруванням етану при 300 – 500°С. Застосовується хлористий етил як етилюючий засіб у виробництві тетраетилсвинцю, етилцелюлози, етиламіну й ін. У медицині застосовується для місцевої анестезії.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 4427; Нарушение авторских прав?; Мы поможем в написании вашей работы!