
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правило произведения растворимости
Равновесие в гетерогенной системе
В аналитической химии часто приходится иметь дело с неоднородными гетерогенными системами. По образованию осадка судят о наличии в растворе различных веществ или ионов. Многие операции количественного анализа также основаны на образовании и отделении осадка. Так как абсолютно нерастворимых веществ в природе не существует, то всегда в растворе будут присутствовать частицы или ионы вещества, находящегося в осадке. Полнота осаждения и растворимость осадка являются очень важными аналитическими характеристиками вещества. Количественно равновесия в гетерогенной системе осадок-раствор характеризуется величиной произведения растворимости.
В насыщенном растворе малорастворимого соединения A m В n устанавливается равновесие между осадком и раствором:
A m В n D m An+ + n Вm –
Данное равновесие может быть количественно охарактеризовано константой равновесия:
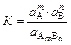 .
.
Так как активность твердой фазы 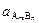 = const, то она включается в константу. Константа этого равновесия называется произведением растворимости (ПР):
= const, то она включается в константу. Константа этого равновесия называется произведением растворимости (ПР):
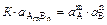 =ПР
=ПР
Отсюда вытекает правило произведения растворимости: в насыщенном растворе малорастворимого соединения произведение активностей ионов в степенях их стехиометрических коэффициентов (в насыщенном растворе малорастворимого электролита) есть величина постоянная для данного растворителя и температуры. С учетом зависимости а = f∙ c предыдущее уравнение можно записать в виде:
ПР = [A] m ×[В] n × 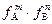 = ПРк ×
= ПРк × 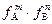 ,
,
где ПРк = [A] m [В] n - концентрационное произведение растворимости. В отличие от термодинамического произведения растворимости эта величина зависит не только от температуры и природы растворителя, но и от ионной силы раствора.
Для малорастворимых соединений в величинами ПР≤10-8 влиянием электростатического взаимодействия ионов в растворе можно пренебречь, тогда
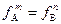 =1 ПР= ПРк = [A] m [В] n.
=1 ПР= ПРк = [A] m [В] n.
Произведение растворимости электролита, состоящего из большего числа разноименных ионов, чем бинарный, равно произведению активностей всех его ионов. Например,
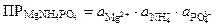 .
.
В приложении данного пособия приведены произведения растворимости (ПР) некоторых малорастворимых веществ.
Расчёт растворимости малорастворимых соединений
Зная величину ПР, можно рассчитать растворимость малорастворимого соединения в заданных условиях. Пусть растворимость малорастворимого электролита типа А т В п в насыщенном водном растворе равна S моль/л. Тогда молярные концентрации ионов А и В равны: [A] = mS, [B] = nS, а произведение растворимости
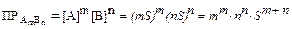 .
.
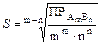
Для бинарного электролита АВ имеем соотношение:
ПРАВ = S 2 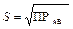
Эти уравнения также используют для расчета ПР по величине S.
Присутствие сильного электролита, не имеющего с осадком одноименного иона, увеличивает растворимость осадка за счет снижения активности ионов в растворе (солевой эффект). Поэтому произведение растворимости должно в этом случае использоваться в термодинамической форме:
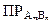 =
= 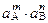 =
= 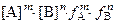 = (mS) m× (nS) n × f A m × f B n =
= (mS) m× (nS) n × f A m × f B n =
= mm× nn× Sm+n× f A m × f B n,
откуда
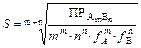 .
.
Из этого уравнения видно, что с ростом ионной силы m растворимость осадка увеличивается, поскольку коэффициенты активностей ионов уменьшаются.
В присутствии сильного электролита, имеющего общий ион с осадком, его растворимость уменьшается вследствие увеличения концентрации одного из ионов кристаллической решетки осадка. Солевой эффект за счет присутствия сильного электролита здесь также имеет место, однако фактор подавления растворимости под действием одноименного иона играет доминирующую роль.
Пример1:Вычислите растворимость BaSO4, если 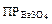 = 1,1×10- 10.
= 1,1×10- 10.
Решение:
BaSO4 D Ba2++SO42-
Равновесные концентрации ионов в насыщенном растворе сульфата бария равны: [Ba2+] = [SO42-] = S. С учетом этих концентраций ПР сульфата бария выразится в виде:
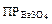 = [Ba2+] ∙ [SO42-] = S× S× = 1,1×10-10.
= [Ba2+] ∙ [SO42-] = S× S× = 1,1×10-10.
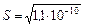 = 1,05×10-5 M.
= 1,05×10-5 M.
Пример 2. Вычислите растворимость BaSO4 в 0,1 М растворе Na2SO4 (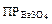 = 1,1×10- 10).
= 1,1×10- 10).
Решение: Растворимость сульфата бария уменьшается из-за присутствия одноименного иона и в то же время повышается из-за увеличения ионной силы. Ионная сила раствора будет определяться преимущественно ионами сильного электролита:
Na2SO4 →2 Na++ SO42-
2∙ 0,1М 0,1М
 (0,2∙12+0,1×22)=0,3.
(0,2∙12+0,1×22)=0,3.
Согласно справочным данным, при m = 0,3 значения
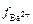 =
= 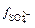 = 0,42. М Равновесные концентрации ионов в насыщенном растворе сульфата бария равны:
= 0,42. М Равновесные концентрации ионов в насыщенном растворе сульфата бария равны:
[Ba2+] = S∙ M; [SO42-] = (0,1+ S)· M.
С учетом этих концентраций и ионной силы раствора ПР сульфата бария выразится в виде:
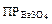 =
= 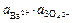 так как
так как 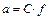
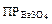 = S× f× (0,1 + S) × f = 1,1×10-10.
= S× f× (0,1 + S) × f = 1,1×10-10.
Поскольку отношение с /ПР = 0,1/1,1× 10-10 >> 400, то справедливо приближение 0,1 + S = 0,1. Тогда получаем простое уравнение
S ×0,1× f 2 = 1,1×10-10 , откуда S = 6,24×10-9 M.
Из расчетов видно, что растворимость BaSO4 в растворе одноименного иона по сравнению с растворимостью в воде (см. Пример1) уменьшилась в 1,05×10-5 /6,24×10-9=1683 раза.
|
|
Дата добавления: 2014-11-16; Просмотров: 4541; Нарушение авторских прав?; Мы поможем в написании вашей работы!