
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правила и принципы заполнения АО электронами
|
|
|
|
1. Принцип минимальной энергии – в основном состоянии первыми заполняются орбитали с наименьшей энергией, соответствующие наиболее устойчивому состоянию. АО с min E – это 1s.
2. Правило В. Клечковского - увеличение энергии орбиталей происходит в порядке возрастания суммы (n+ l), а при равной сумме (n+ l) в порядке возрастания n
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈5d≈4f<6p<7s≈6d≈5f<7p
Для 4s АО сумма (n+l) =4+0=4. Для 3d АО сумма (n+l) =3+2=5
3. Принцип запрета Паули - в атоме не может быть двух электронов, обладающих одинаковым набором четырех квантовых чисел n, l, m l, ms. Следовательно, на каждой орбитали может быть не более двух электронов, причем они должны иметь противоположные спины (↑↑ или ↓↓ - невозможно).
| ↑↓ |
4. Правило Гунда – электроны, имеющие одинаковое значение l, но разное m l занимают АО так, чтобы сумма спиновых чисел была максимальной (знак не имеет значения).
р 4
| ↑↓ | ↑ | ↑ |
Max ∑ ms = ½ - ½ + ½ + ½ = 1
Электронная конфигурация атома - запись распределения электронов в атоме по уровням и подуровням. Формирующий электрон – ē, который последним заполняет орбитали атома.
15Р 1s2 2s2 2p6 3s2 3p3 - полная электронная формула.
Р … 3s2 3p3 3s 3p
| ↓↑ | ↓ | ↓ | ↓ |
краткая электронная конфигурация. Формирующий электрон 3p3: n=3, l =1 m l = -1,0,+1 (одно из трех значений), ms = +½ или -½.
Валентные электроны составляют краткую электронную конфигурацию атома
В ПСЭ различают 4 группы элементов, называемых по формирующему электрону s-, p-, d-, f- элементы.
Краткая электронная конфигурация:
для s-элементов (подгруппы IА, IIА, Н и Не) ns1-2, n- номер периода
19К …4s1
для p- элементов (IIIА–VIIIА) ns2np1-6,
|
|
|
4B …2s22p1
для d-элементов (IБ–VIIIБ) (n-1)d1-10ns2(1,0 ) (n-1)–предвнешний энергетический уровень,
21Sc …3d14s2
(– у Pd; ns1,0 –«провал» ns- электронов на (n-1)d подуровень, это связано с более низкой энергией конфигурации (n-1)d10 и (n-1)d5по сравнению с d9 и d4)
для f-элементов (лантанидов и актинидов) (n-2)f1-14(n-1)d1(0)ns2 (n-2)–предпредвнешний энергетический уровень (d0 –«провал» d-электрона)
64Gd …4 f7 5d1 6 s2
Валентность - способность атома образовывать определенное число химических связей. Валентность по обменному механизму равна числу внешних неспаренных электронов в атоме. Различают валентность в основном (В) и возбужденном (В*) состоянии атома.
Кислород, азот и фтор – возбужденного состояния нет (нет 2d-подуровня)
Распаривание электронов возможно только в пределах одного энергетического уровня.
У магния Mg…3s2 в основном состоянии нет неспаренных электронов (В=0), при переходе в возбужденное состояние и распаривании 3s-ē В*=2.
Хлор Cl…3s23p5 (аналог фтора) – валентности: В=1, В*= 3, 5, 7 - вследствие наличия свободных d -орбиталей на третьем энергетическом уровне
 |
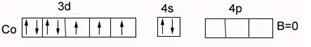
У кобальта Cо…3d74s2 В0=0 – нет внешних неспаренных электронов в основном состоянии. В возбужденном состоянии В*=2,3,4,5, распаривания 3d парных ē невозможно (на n=3 нет f-подуровня).


Физический смысл периодического закона:
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1054; Нарушение авторских прав?; Мы поможем в написании вашей работы!