
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы
|
|
|
|
Растворами называют гомогенную часть многокомпонентной системы, состав которой может произвольно меняться, относительное содержание компонентов в растворе может быть любым.
Состав – основная характеристика растворов, выражается:
1) в относительных единицах хi = пi / пр-ра – молярная доля х1 + х2 + … хк = 1(100%)
2) в специальных:
а) молярная концентрация сi = пi /Vр-ра [c] = 1 моль/л = М(молярность)
n- количество растворённого вещества
V – объём раствора
б) моляльная концентрация mi = ai / (Mi ×g) [mi] = 1 моль/кг = 1 Мл (моляльность)
g – масса растворителя
аi, Mi – масса, молярная масса растворённого вещества.
Моляльная концентрация определяется число моль вещества, растворённых в 1 кг растворителя.
В растворах наблюдается диффузия растворённого вещества и растворителя, это приводит к выравниванию концентрации в объёме раствора.
Если отделить раствор от растворителя через мембрану (полупроницаемую перегородку типа сита), то наблюдается односторонняя диффузия растворителя к раствору, которая называется осмосом. А давление частиц растворённого вещества на мембрану называется осмотическим давлением.
Вант – Гофф (1887 г) установил закон:
Осмотическое давление π(пи) пропорционально молярности раствора и температуре
π = сRT - для растворов неэлектролитов.
π = iсRT – для электролитов.
i – изотонический коэффициент, поправка на диссоциацию.
i = 1 + a(К - 1)
a - степень диссоциации
К –число ионов, на которое распадается электролит, например
К(NaCl) = 2; K(K2SO4) = 3
[π] = Па.
Давление пара над жидкостью зависит от испаряемости и температуры. Давление пара над чистым растворителем РА° всегда выше давления пара над раствором с нелетучим компонентом РА.
|
|
|
РА° > PA PA° – PA = DP
Рауль (1884 г) устанавливает закон: РА = РА°ХА – первый закон Рауля.
Давление пара над раствором нелетучего вещества пропорционально мольной доле растворителя в растворе.
Или после преобразования получим вторую формулу закона Рауля
DР/РА° = ХВ DР/РА° - депрессия раствора.
Для растворов электролитов перед Х вводится изотонический коэффициент.
Из-за понижения давления пара растворителя над растворами нелетучих веществ температура замерзания растворов всегда ниже температуры замерзания чистых растворителей, а температура кипения выше.
TЗ > TЗ ׳ TЗ ׳, TЗ – температура замерзания раствора и растворителя.
DТЗ = ТЗ - ТЗ ׳ – понижение Т замерзания
ТК ׳ > TK TK ׳, TK – температура кипения раствора и растворителя.
DТК = ТК ׳ – TK – повышение Т кипения.
Второй закон Рауля устанавливает:
Понижение температуры замерзания и повышение температуры кипения раствора пропорционально моляльности (m) раствора с нелетучим компонентом.
DТЗ = КК×m
– второй закон Рауля.
DTK = Kэб × m
КК – криоскопическая постоянная;
Kэб – эбуллиоскопическая постоянная.
Для каждого растворителя имеется своя КК, Kэб (справочная величина).
Для растворов электролитов перед m вводится i.
Многие жидкости можно смешивать в любых пропорциях – неограниченно растворимые жидкости (вода и уксусная кислота), в других случаях – ограниченно растворимые (вода и фенол), в третьем случае взаимонерастворимые жидкости (вода и углеводороды).
В идеальных растворах силы межмолекулярного взаимодействия между молекулами одинаковы, то есть испарение каждой из жидкостей происходит независимо от другой и к каждой из жидкостей применяется 1 закон Рауля.
Рсм = РА + РВ = ХА × РА° + ХВ × РВ°.
Применяя к таким системам закон Дальтона: РА = Рсм ХАn; PB = Pсм×ХВn
и 1 закон Рауля РА = РА°ХА; РВ = РА°ХВ
|
|
|
А, В – компоненты смеси (растворённое вещество и растворитель)
ХАn; XBn – молярные доли компонентов в паре над раствором
Получаем закон Рауля – Дальтона: 
РА°/РВ° = a - относительная испаряемость.
Если a > 1, то относительное содержание компонента А в паре над раствором больше, чем в растворе.
Если a < 1, то наоборот компонента В больше в паре, чем в растворе.
Если a = 1. состав пара над раствором одинаков с составом раствора.
На этом законе основываются процессы перегонки, ректификации. Это массообменные процессы.
Перегонка – общепринятый метод разделения смеси жидкостей на составные части или для выделения какого-либо компонента из сложной смеси, основан на разности температур кипения.
Для увеличения степени разделения компонентов применяют перегонку с дефлегматором.
Ректификация – более эффективный способ разделения, основывается на непрерывном и многократном чередовании испарения жидкости с конденсацией пара в ректификационной колонне.
Эти процессы основываются на законах Коновалова.
1 закон Коновалова:
Над двойной жидкой системой пар относительно жидкости богаче тем компонентом, прибавление которого к системе повышает общее давление пара – понижает температуру кипения смеси при данном давлении.
2 закон Коновалова:
Экстремумы (max или min) на кривых давления пара над растворами соответствуют жидкости и пару с одинаковым составом.
Растворы, состав которых отвечает указанным экстремальным точкам, называют азеотропными смесями – нераздельно кипящие смеси (то есть разделить их простой перегонкой невозможно), с одинаковым составом жидкости и пара.
Перегонка с водяным паром используется для снижения температуры перегонки, то есть смесь кипит при Т = const, которая ниже самого низкокипящего компонента – воды (вещество А). Тперегонки < 100°C.
Используя закон Дальтона Рi Vсм = miRT/Mi. можно вывести формулу расходного коэффициента Х: 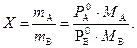
Он выражает массу водяного пара (mA), приходящееся на 1кг пара органического вещества (mB) в паре над смесью.
МА, МВ – молярные массы воды и органического вещества.
Если в систему, состоящую из двух взаимонерастворимых жидкостей ввести третье вещество, которое растворимо в обеих жидкостях, то оно распределится между ними определённым образом.
|
|
|
В 1890 г. Нернст сформулировал закон распределения.
При Т = const отношение концентраций вещества (третьего компонента), растворённого в двух фазах, постоянно.
c1/с2 = K K – коэффициент распределения.
(с1)n/с2 = К – закон распределения Шилова.
n – const, зависит от Т, природы всех компонентов.
На законе распределения основан метод экстрагирования или экстракция – способ извлечения веществ из сложных систем, обработкой их селективным растворителем – выборочным экстрагентом.
В результате экстракции образуется экстракт – раствор извлечённых компонентов в экстрагенте и рафинат – обработанная смесь, обеднённая извлекаемым компонентом (исходная смесь).
Экстракцию обычно ведут ступенчато, n-кратно.
Расчёты ведут по формуле: 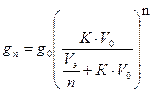
V0 – объём исходного раствора, в котором находится извлекаемый компонент;
V Э– объем экстрагента;
К – коэффициент распределения;
g 0 – масса экстрагируемого вещества в исходном растворе;
g 1 – масса экстрагируемого вещества в рафинате;
g0 – g1 – масса экстрагируемого вещества в экстракте;
п – число ступеней экстракции.
При соприкосновении газа с жидкостью происходит поглощение газов жидкостью – процесс абсорбции.
Этот процесс характеризуется коэффициентом абсорбции a - это тот объём газа, приведённый к н.у., который приходится на 1 объём жидкости при нормальном давлении и данной Т.
Зависимость растворимости газа от давления выражается законом Генри:
При Т = const растворимость газа в жидкости прямо пропорциональна давлению этого газа над раствором.
Сж = К Р - закон Генри
Сж – концентрация газа в жидкости
Р – давление этого газа
К – коэффициент Генри.
При T = const сж/сг = S
сг – концентрация газа в газовой фазе.
S – коэффициент растворимости.
Взаимосвязь между a и S выражается следующей формулой: S/a = Т/Т0
Для газовой смеси используется закон Генри-Дальтона: сi = K ' Pi
При T = const растворимость каждого компонента идеальной газовой смеси в жидкости прямо пропорциональна давлению этого газа (парциальное Р) в смеси газов над раствором.
|
|
|
Примеры решения задач.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 573; Нарушение авторских прав?; Мы поможем в написании вашей работы!