
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимия
|
|
|
|
Вопросы к семинару
1. Способы выражения состава раствора. Вывод формул перехода от одного способа выражения состава раствора к другому.
3. Рассчитать объем 98%-ной серной кислоты (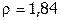 г/мл) для приготовления: а) 200 мл 84,3% раствора (
г/мл) для приготовления: а) 200 мл 84,3% раствора (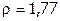 г/мл); б) 400 мл 0,01н раствора (
г/мл); б) 400 мл 0,01н раствора (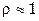 г/мл).
г/мл).
4. Решить одну из следующих задач каждому студенту по [6] №223-231.
Химические реакции, как правило, сопровождаются тепловыми эффектами, которые изучают в специальном разделе – термохимии.
Термохимические расчеты основаны на применении закона Гесса (1836 г.): тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от способа ее проведения, и определяется лишь начальным и конечным состоянием системы реагирующих веществ. В частности, если процесс идет в несколько стадий при р=const, то его общий тепловой эффект (DH) равен сумме тепловых эффектов всех этих стадий [8].
Теплота растворения соли. Растворение представляет собой физическое или химическое явление в зависимости от природы веществ. Химические процессы растворения, как и химические реакции, сопровождаются значительными тепловыми эффектами. Рассмотрим, почему одни соли в воде растворяются с выделением тепла, как, например: 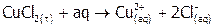 ,
, 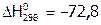 кДж/моль,
кДж/моль,
а другие – с поглощением: 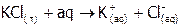 ,
, 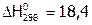 кДж/моль.
кДж/моль.
При растворении соли в воде происходят два основных процесса. Первый – эндотермический, связанный с разрушением кристаллической решетки; второй – экзотермический, обусловленный гидратацией ионов соли (причем DH образования гидратов тем отрицательнее, чем выше заряд иона и меньше его радиус). И если по абсолютной величине DH первого процесса больше, то растворение идет с эндоэффектом; если же второго, то – с экзоэффектом.
|
|
|
Теплота нейтрализации. Тепловой эффект реакции нейтрализации, как и других химических процессов, можно представить алгебраической суммой энтальпий (т.е. DH) разрушения прежних химических связей и образования новых.
Так, при смешении растворов сильной кислоты и щелочи энергия затрачивается на разрушение гидратных оболочек ионов водорода (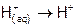 ) и гидроксила (
) и гидроксила (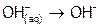 ), но выделяется при образовании молекул воды (
), но выделяется при образовании молекул воды (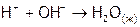 ). Тепловой эффект суммарного процесса:
). Тепловой эффект суммарного процесса: 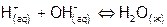 равен алгебраической сумме указанных теплот. (Здесь не учитываются теплоты взаимного разбавления при смешении растворов.)
равен алгебраической сумме указанных теплот. (Здесь не учитываются теплоты взаимного разбавления при смешении растворов.)
При взаимодействии щелочи со слабой кислотой энергия затрачивается не только на дегидратацию реагирующих частиц, но и на осуществление диссоциации слабого электролита, например: 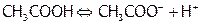 .
.
Последний процесс более энергоемок, чем дегидратация ионов, поэтому суммарный тепловой эффект данной реакции нейтрализации менее отрицателен, чем при взаимодействии щелочи с сильной кислотой.
.
ЛАБОРАТОРНАЯ РАБОТА «Определение тепловых эффектов»
Для определения тепловых эффектов химических процессов их проводят в специальном приборе – калориметре, а величину DH рассчитывают по изменению температуры (Dt) в ходе данного процесса, используя теплового значения калориметра (К), по формуле:
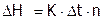 (кДж/моль),
(кДж/моль),
где n – количество реагента, взятого в недостатке. Значение К показывает, какому тепловому эффекту соответствует повышение температуры на один градус, иначе говоря: Кравно количеству тепла, которое необходимо затратить, чтобы нагреть калориметр с его содержимым на 10С, и имеет размерность: кДж/(моль*градус).
Поскольку К представляет собой сумму теплоемкостей всех составных частей, входящих в калориметрическую систему, то его можно определить, точно зная массы и удельные теплоемкости всех деталей и содержимого калориметра. Но в настоящей работе значение К предлагается найти экспериментально по 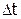 при строго определенном разбавлении серной кислоты, DH которого известен.
при строго определенном разбавлении серной кислоты, DH которого известен.
|
|
|
 1. Определение
1. Определение 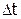 при разбавлении кислоты.
при разбавлении кислоты.
а) С помощью ареометра определить концентрацию имеющейся в наличии концентрированной серной кислоты и приготовить из нее 200 мл 84,3%-го раствора (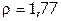 г/мл) – один на подгруппу,охладить его до комнатной Т.
г/мл) – один на подгруппу,охладить его до комнатной Т.
б) Собрать установку (рис. 4). Она состоит из сосуда Дьюара (1) емкостью 1 л, внутри которого помещены теплоизолирующая прокладка (2) и стакан (3) объемом 200 мл. Сосуд Дьюара закрывается крышкой (4), имеющей три отверстия: для помещения термометра (5), небольшой воронки с широким тубусом (6) и мешалки (7). При помощи специального держателя укрепить термометр (его перед началом опыта надо вставлять в калориметр последним, а после окончания опыта вынимать из установки в первую очередь).
в) Чтобы определить 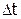 при разбавлении кислоты, в стакан (3) с помощью мерного цилиндра налить 100 мл воды и измерить ее Т.
при разбавлении кислоты, в стакан (3) с помощью мерного цилиндра налить 100 мл воды и измерить ее Т.
Показания термометра нужно снимать следующим образом: один студент перемешивает жидкость с помощью мешалки; одновременно он следит за секундомером и диктует время отсчета. За пять секунд до начала отсчета диктующий говорит: «Внимание». В это время второй студент с лупой оценивает приблизительное положение ртутного столбика в термометре и, когда диктующий скажет: «Отсчет!» – записывает соответствующие показания термометра. Их следует фиксировать с помощью лупы до десятых долей градуса через каждую минуту на протяжении всего опыта.
Эксперимент начинают с определения температурного хода калориметра. Для этого измеряют температуру содержимого калориметра в течение не менее 5 мин (начальный период опыта). Если при этом изменения Т достаточно равномерны и невелики, то начинают главный период опыта (при котором также фиксируют показания термометра); т.е. в определенный момент в калориметр через воронку, не прекращая перемешивания, добавляют второй реагент – 3,45 мл полученного раствора кислоты (его отмерить пипеткой на 10 мл с делениями).
После того, как процесс (разбавление кислоты) закончится, температурный ход в калориметре снова станет равномерным и небольшим. В этом последнем периоде опыта температурные отсчеты делать в течение 5 мин. Провести не менее двух параллельных опытов по определению 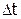 при разбавлении кислоты.
при разбавлении кислоты.
|
|
|
2. Определение 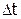 при растворении соли. С точностью до 0,01 г взять навеску (из приведенных в табл. 10) одной из солей, указанной преподавателем.
при растворении соли. С точностью до 0,01 г взять навеску (из приведенных в табл. 10) одной из солей, указанной преподавателем.
В калориметр с помощью мерного цилиндра налить 80 мл воды (комнатной температуре) и далее, используя методику опыта 1в, определить 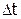 растворения соли, высыпая ее навеску в воду в начале главного периода. Провести два параллельных опыта по определению
растворения соли, высыпая ее навеску в воду в начале главного периода. Провести два параллельных опыта по определению 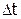 растворения соли.
растворения соли.
Таблица 10. Навески солей для определения DH их растворения
| Название соли | Формула | Навеска, г |
| Хлорид калия | 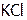
| 6,55 |
| Кристаллическая сода | 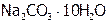
| 3,26 |
| Дихромат калия | 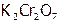
| 3,34 |
| Гидрофосфат натрия (12-ти водный) | 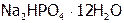
| 4,07 |
Таблица 11. Теплоты растворения некоторых солей в воде
| № | Соль | Число молей воды на 1 моль соли | t 0C | 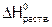 ,
кДж/моль ,
кДж/моль
|
| 18,4 | |||
 [18] [18]
| 67,3 | |||
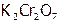
| 69,9 | |||
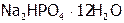
| 95,6 |
3. Определение 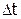 при реакции нейтрализации. Рассчитать, какую навеску щелочи нужно взять для приготовления 1 л раствора (один на подгруппу), в 100 мл которого содержалось бы на 5% меньше молей эквивалентов щелочи, чем количество эквивалентов серной кислоты в 3,45 мл 84,3%-го раствора. По результатам расчета приготовить раствор щелочи и охладить его до комнатной температуры. Налить в калориметр 100 мл полученного раствора щелочи и определить
при реакции нейтрализации. Рассчитать, какую навеску щелочи нужно взять для приготовления 1 л раствора (один на подгруппу), в 100 мл которого содержалось бы на 5% меньше молей эквивалентов щелочи, чем количество эквивалентов серной кислоты в 3,45 мл 84,3%-го раствора. По результатам расчета приготовить раствор щелочи и охладить его до комнатной температуры. Налить в калориметр 100 мл полученного раствора щелочи и определить 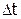 ее нейтрализации (используя методику опыта 1в) при добавлении (в начале главного периода) 3,45 мл 84,3%-ой серной кислоты. Опыт провести 2 раза.
ее нейтрализации (используя методику опыта 1в) при добавлении (в начале главного периода) 3,45 мл 84,3%-ой серной кислоты. Опыт провести 2 раза.
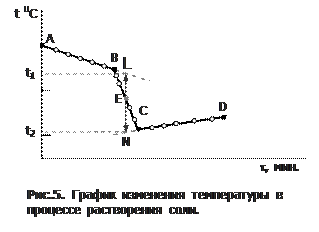 Поправки на теплообмен со средой. Результаты опытов 1, 2 и 3 изобразите в виде графиков на миллиметровой бумаге, откладывая на оси абсцисс время в минутах (1 см – это 1 мин), а на оси ординат – показания термометра (пример графика для опыта 2 показан на рис. 5).
Поправки на теплообмен со средой. Результаты опытов 1, 2 и 3 изобразите в виде графиков на миллиметровой бумаге, откладывая на оси абсцисс время в минутах (1 см – это 1 мин), а на оси ординат – показания термометра (пример графика для опыта 2 показан на рис. 5).
Подчеркнем, что именно наличие температурного хода в начальном (АВ) и конечном (СД) периодах свидетельствует о том, что во время опыта имеет место теплообмен калориметра с окружающей средой. В расчетах это учитывается следующим образом: прямая АВ экстраполируется вправо, СД – влево. Через среднюю точку (Е) отрезка ВС проводится перпендикуляр к оси абсцисс до пересечения его с линиями АВ и CD. Величина отрезка LN соответствует изменению температуры калориметра: 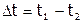 , вызванному только проводимым процессом.
, вызванному только проводимым процессом.
|
|
|
Расчеты теплового значения калориметра и 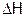 . Исходя из того, что величина
. Исходя из того, что величина 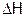 разбавления кислоты (опыт 1) равна –46,2 кДж/моль, рассчитать тепловое значение калориметра (величину К), используя вышеприведенное равенство.
разбавления кислоты (опыт 1) равна –46,2 кДж/моль, рассчитать тепловое значение калориметра (величину К), используя вышеприведенное равенство.
Затем найти 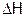 растворения соли (опыт 2) по формуле:
растворения соли (опыт 2) по формуле:
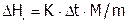 (кДж/моль), где m – навеска (в граммах) соли, М – ее мольная масса. Сравнить со справочным значением
(кДж/моль), где m – навеска (в граммах) соли, М – ее мольная масса. Сравнить со справочным значением 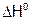 (табл. 11). Указать причины возможных расхождений. Рассчитать погрешность эксперимента.
(табл. 11). Указать причины возможных расхождений. Рассчитать погрешность эксперимента.
Аналогично определить 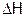 процесса нейтрализации с учетом
процесса нейтрализации с учетом 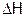 разбавления кислоты (опыт 3). Объяснить причины отклонения найденного значения теплоты нейтрализации от справочного:
разбавления кислоты (опыт 3). Объяснить причины отклонения найденного значения теплоты нейтрализации от справочного:
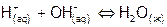 ,
, 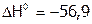 кДж/моль.
кДж/моль.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1123; Нарушение авторских прав?; Мы поможем в написании вашей работы!