
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Разбавления
С разбавлением растворов электролитов молярная электрическая проводимость увеличивается и стремится к максимальному значению, называемому предельной молярной электрической проводимостью (λ∞).
Для слабых электролитов это объясняется тем, что при бесконечном разбавлении степень диссоциации достигает предельного значения, α =1. Отсюда можно рассчитать степень диссоциации слабого электролита при данной концентрации:
α = 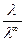 (6.7)
(6.7)
и константу диссоциации:
K = 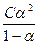 =
= 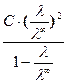 (6.8)
(6.8)
Для сильных электролитов при бесконечном разбавлении ионы удалены друг от друга на такие расстояния, что не мешают при их движении к электродам. Отсюда можно вычислить коэффициент электрической проводимости раствора:
f = λ/λ∞ (6.9)
Предельную молярную электропроводность иона λ∞К+ и λ∞An–можно вычислить и эти значения приведены в справочных таблицах
С помощью закона Кольрауша можно рассчитать предельную молярную электрическую проводимость данного электролита.
Предельная молярная электрическая проводимость электролита равна сумме предельных молярных проводимостей ионов, входящих в его состав. λ∞ = λ∞К+ + λ∞An– (6.10)
Значение λ определяют экспериментально, λ∞ - рассчитывают по закону Кольрауша.
|
|
Дата добавления: 2014-11-20; Просмотров: 662; Нарушение авторских прав?; Мы поможем в написании вашей работы!