
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие о рН
|
|
|
|
Лекции №7
Со школы известно, что в водных растворах кислоты диссоциируют, например:
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
H3PO4 = 3H+ + PO43-
При этом в растворе возникают свободные ионы водорода с концентрацией [H+]. Для количественной характеристики кислотности раствора вводится величина рН раствора, которая по определению есть
рН= -lg[H+]
Рассмотрим типичные примеры расчета рН, которые основаны на законе действующих масс.
По закону действующих масс, для любой обратимой химической реакции вида

 SаiAi
SаiAi  SbjBj,
SbjBj,
константа равновесия К, отвечающая равенству скоростей прямой и обратной реакции, определяется уравнением
П[Bj]bj
K= ¾¾¾
П[Ai]ai
1. рН чистой воды.
Молекулы воды подвержены диссоциации
H2O = H+ + OH- 

В согласии с законом действующих масс выражение для константы равновесия принимает вид
[H+]× [ OH-]
K= ¾¾¾¾¾
[H2O]
В 1 л (m=1000 г) воды (молекулярный вес которой М=18 г) содержится n=m/M=1000/18=55.5 молей. Следовательно, концентрация воды в воде равна [H2O]=55.5 моль/л.
Опыт показывает, что произведение К× [H2O]=10-14, поэтому можно записать
[H+]× [ OH-]=10-14
Это произведение называют ионным произведением воды и обозначают так
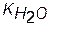 , т.е.
, т.е.
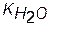 = [H+]×[OH-]
= [H+]×[OH-]
Запомним, что 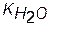 =10-14.
=10-14.
При диссоциации молекул воды H+ ионы и OH- анионы образуются в равных количествах, т.е. в чистой воде [H+]=[OH-]. Следовательно,
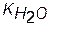 =[H+]2
=[H+]2
поэтому [H+]= 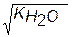 и рН= -1/2lg(
и рН= -1/2lg(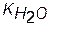 )=7.
)=7.
Итак, в чистой воде концентрации Н+ и ОН- ионов равны, поэтому вода является нейтральной средой, которой соответствует рН=7.
Добавление к воде молекул кислоты увеличивает концентрацию ионов водорода, снижая рН. Следовательно, все кислые растворы имеют рН<7.
Добавление к воде ОН- ионов должно приводить к снижению концентрации ионов водорода, т.к.
|
|
|
[H+]= 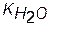 /[OH-]
/[OH-]
Следовательно, все щелочные растворы имеют рН>7.
2. рН сильных кислот.
Если при диссоциации кислоты
HAn= H+ + An-
равновесие полностью смещено вправо, т.е. концентрация недиссоциированных молекул [HAn] близка к нулю, то такая кислота называется сильной кислотой.
Допустим, что взят раствор кислоты с начальной концентрацией [HAn]0, причем вся эта кислота находится в недиссоциированном виде.
Пусть теперь в результате диссоциации кислоты возникли ионы водорода в концентрации [H+], при этом концентрация недиссоциированной кислоты станет [HAn]= [HAn]0 - [H+]. Поскольку по условию [HAn]»0, то можно считать, что [H+]= [HAn]0. Следовательно,
рН= -lg([HAn]0)
3. рН слабых кислот.
Для расчета рН необходимо определить равновесное значение концентрации ионов водорода, т.е. величину [H+].
При диссоциации слабых кислот
HAn= H+ + An-
не все молекулы кислоты диссоциируют на ионы, а только их часть. Остальные молекулы остаются в недиссоциированном виде и находятся в равновесии с ионами водорода и анионами кислоты. В этом случае закон действующих масс принимает вид
[H+]× [ An-]
KД = ¾¾¾¾¾
[HAn]
где константу равновесия KД называют константой диссоциации), численное значение дается в справочнике).
Имеем одно уравнение с 3 неизвестными ([H+],{An-] и [HAn]). Поэтому для нахождения неизвестных надо найти еще два недостающих уравнения.
Одно из недостающих уравнений находим таким образом. Допустим, что из-за диссоциации кислоты ее концентрация уменьшилась на х молей. Поэтому если до диссоциации концентрация кислоты равнялась [HAn]0, то после установления равновесия она станет
[HAn]= [HAn]0 - х.
Второе недостающее уравнение найдем из уравнения диссоциации кислоты.
HAn= H+ + An-
Из уравнения реакции следует, что из 1 моля кислоты образуется 1 моль ионов водорода и 1 моль анионов. Поскольку согласно схеме реакции при диссоциации кислоты ионы водорода и анионы кислоты возникают в одинаковых количествах, то третьим уравнением будет условие
|
|
|
[H+]×=[An-]= x.
Следовательно, выражение для константы диссоциации принимает вид
x2
KД = ¾¾¾¾¾
[HX]0 - x
Отсюда можно найти концентрацию ионов водорода и рассчитать рН. Но это уравнение можно упростить, если принять, что для слабой кислоты реализуется условие [HX]0 >>x= [H+]. В этом случае получаем
________
x=[H+]= ÖKД[HX]0
откуда, после логарифмирования, находим искомое выражение
рН= -1/2lg(KД) - 1/2lg([HX]0)
4. рН сильных оснований.
При диссоциации сильных оснований
МеОН = Меn+ + OH-
равновесие этой реакции полностью смещено вправо, и концентрация ионов гидроксила [OH-] =[MeOH]0 (аналогия с задачей для сильных кислот).
Учитывая ионное произведение воды, находим, что
[H+]= 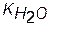 /[OH-]=
/[OH-]= 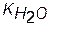 /[MeOH]0
/[MeOH]0
После логарифмирования находим искомое выражение
pH= 14 + lg([MeOH]0)
5. рН слабых оснований
Для расчета рН необходимо определить равновесное значение концентрации ионов водорода, т.е. величину [H+].
При диссоциации слабых оснований
МеОН = Ме+ + OH-
не все молекулы основания диссоциируют на ионы, а только их часть. Остальные молекулы остаются в недиссоциированном виде и находятся в равновесии с ионами гидроксила и катионами металла. В этом случае закон действующих масс принимает вид
[Me+] ×[ OH-]
KД = ¾¾¾¾¾
[MeOH]
где константу равновесия KД называют константой диссоциации), численное значение дается в справочнике).
Имеем одно уравнение с 3 неизвестными ([Me+],{OH-] и [MeOH]). Поэтому для нахождения неизвестных надо найти еще два недостающих уравнения.
Одно из недостающих уравнений находим таким образом. Допустим, что из-за диссоциации основания его концентрация уменьшилась на х молей. Поэтому если до диссоциации концентрация основания равнялась [MeOH]0, то после установления равновесия она станет
[MeOH]= [MeOH]0 - х.
Второе недостающее уравнение найдем из уравнения диссоциации основания.
Из уравнения реакции следует, что из 1 моля основания образуется 1 моль ионов металла и 1 моль ионов гидроксила. Поскольку согласно схеме реакции при диссоциации основания ионы металла и гидроксила возникают в одинаковых количествах, то третьим уравнением будет условие
|
|
|
[Me+]×=[OH-]= x.
Следовательно, выражение для константы диссоциации принимает вид
x2
KД = ¾¾¾¾¾
[MeOH]0 - x
Отсюда можно найти концентрацию ионов водорода и рассчитать рН. Но это уравнение можно упростить, если принять, что для слабого основания реализуется условие [MeOH]0 >>x= [OH-]. В этом случае получаем
___________
x=[OH-]= ÖKД[MeOH]0
Учитывая ионное произведение воды, находим, что
___________
[H+]= 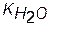 /[OH-]=
/[OH-]= 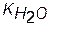 /ÖKД[MeOH]0
/ÖKД[MeOH]0
откуда, после логарифмирования, находим искомое выражение
рН= 14+1/2lg(KД) + 1/2lg([MeOH]0)
6. рН сильных двухосновных кислот.
При диссоциации двухосновной кислоты в одну стадию
H2An = 2H+ + An2-
из одного моля кислоты образуется 2 моля ионов водорода. Следовательно, [H+]= 2[HАn]0 и
рН= -log(2 [H2An]0)
Практически многоосновные кислоты диссоциируют в несколько стадий. Так, двухосновная кислота диссоциирует в две стадии (по двум ступеням):
H2An = H+ + HAn- первая ступень
HAn- = H+ + An2- вторая ступень
Каждая ступень диссоциации характеризуется своей константой равновесия
[H+]×[HAn-]
K1 Д = ¾¾¾¾¾
[H2An]
[H+]×[An2-]
K2 Д = ¾¾¾¾¾
[HAn-]
Из последнего уравнения получаем
[H+]×[An2-]
[HAn-] = ¾¾¾¾¾
K2 Д
Подставив это выражение в уравнение для константы равновесия по первой ступени, получаем уравнение
[H+]2×[An2-]
КД= K1 Д K2 Д = ¾¾¾¾¾
[H2An]
где через КД обозначено произведение констант диссоциации кислоты по первой и второй ступеням.
С другой стороны для суммарной реакции
H2An = 2H+ + An2-
закон действующих масс должен иметь вид
[H+]2×[An2-]
КД= ¾¾¾¾¾
[H2An]
что совпадает с предыдущим уравнением для стадийной схемы диссоциации кислоты.
Таким образом, состояние равновесия для двухстадийной реакции диссоциации двухосновной кислоты можно описать суммарной (одностадийной) реакцией, если ввести эффективную константу равновесия
КД= K1 Д K2 Д.
Если в результате диссоциации концентрация кислоты уменьшилась на х молей, то
[H2An]= [H2An]0 -х
При этом в согласии с суммарным уравнением диссоциации имеем
|
|
|
[H+]= 2х, [An2-] = x
поэтому для константы равновесия можем записать
(2х)2х
КД= ¾¾¾¾¾
[H2An]0 -х
При х<< [H2An]0 находим
x=(КД [H2An]0 /4)1/3
Следовательно,
рН= -lg(2x)
Лекция №8.
Гидролиз солей.
Гидролизом солей называют реакцию между молекулами соли и воды
соль + вода = основание + кислота
По существу гидролиз соли является реакцией, обратной реакции нейтрализации.
Возможны случаи:
а) если в результате гидролиза соли образуются слабое основание и слабая кислота, или сильное основание и сильная кислота, то рН раствора не изменяется (основание и кислота по силе компенсируют (нейтрализуют) друг друга, например:
NaCl + H2O = NaOH + HCl
б) если в результате гидролиза образуется сильное основание, но слабая кислота, то побеждает сильнейший, и раствор становится щелочным (рН повышается);
Na2CO3 + 2H2O = 2NaOH + H2CO3 гидролиз соды
и) если в результате гидролиза образуется слабое основание, но сильная кислота, то снова побеждает сильнейший, и раствор становится кислым (рН понижается)
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
Эта реакция является результатом сложения трех последовательных реакций (ступеней) гидролиза:
FeCl3 + H2O = Fe(OH)Сl2 + HCl
Fe(OH)Сl2+ H2O = Fe(OH)2Cl + HCl
Fe(OH)2Cl+ H2O= Fe(OH)3 + HCl
Основной вклад в рН раствора вносит первая ступень гидролиза.
Учитывая, что средняя соль FeCl3 и основная соль Fe(OH)Сl2 диссоциируют
FeCl3 = Fe3+ + 3Cl-
Fe(OH)Сl2 = Fe(OH)2+ + 2Cl-
Перепишем реакцию гидролиза хлорида железа по первой ступени
FeCl3 + H2O = Fe(OH) Сl2 + HCl
в ионном виде:
Fe3+ + 3Cl- + H2O = Fe(OH)2+ + H+ + 3Cl-
или после сокращений
Fe3+ + H2O = Fe(OH)2+ + H+
Подобные реакции, в которых гидролизу подвергаются катионы соли иногда называют гидролизом по катиону.
Константа равновесия для реакции гидролиза называется константой гидролиза и по закону действующих масс она равна
[Fe(OH)2+]×[H+]
KГ = ¾¾¾¾¾ ¾¾
[Fe3+]
Во всех водных растворах [H2O]»55 моль/л остается постоянной, поэтому она включена в KГ.
Допустим, что начальная концентрация недиссоциированной соли FeCl3 равнялась [FeCl3]0. После ее полной диссоциации на ионы начальная концентрация Fe3+ должна равняться
[Fe3+]0 = [FeCl3]0
Если до момента наступления равновесия в реакцию гидролиза вступило х молей Fe3+, то равновесная концентрация ионов железа станет
[Fe3+] = [Fe3+]0 -х=[FeCl3]0 -х
Из уравнения реакции гидролиза следует, что ионы Fe(OH)2+ и H+ образуются в равных количествах, поэтому в состоянии равновесия будет
[Fe(OH)2+] = [H+]=х
Поэтому выражение для константы гидролиза соли принимает вид
х2
KГ = ¾¾¾¾
[FeCl3]0 -х
Отсюда при [FeCl3]0 >>х получаем
________
x=[H+]= ÖKГ[FeCl3]0
Следовательно, искомое рН при гидролизе соли будет равно
рН= - 1/2lg(KГ[FeCl3]0)
т.е. оно определяется константой гидролиза и концентрацией растворенной соли.
При реакции гидролиза
Fe3+ + H2O = Fe(OH)2+ + H+
образуются частицы Fe(OH)2+, которые могут диссоциировать по схеме
Fe(OH)2+ = Fe3+ + OH-
Константа диссоциации для этой реакции равна
[Fe3+] [OH-]
KД = ¾¾¾¾¾
[Fe(OH)2+]
Отсюда получаем
[Fe3+] [OH-]
[Fe(OH)2+] = ¾¾¾¾¾
KД
Подставим найденную концентрацию [Fe(OH)2+] в уравнение для константы гидролиза
[Fe(OH)2+]×[H+]
KГ = ¾¾¾¾¾ ¾¾
[Fe3+]
при этом получим
[Fe3+]×[H+] [OH-] 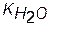
KГ = ¾¾¾¾¾ ¾¾ = ¾¾
KД [Fe3+] KД
так как
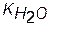 = [H+]×[OH-]
= [H+]×[OH-]
Следовательно, константа гидролиза соли выражается через ионное произведение воды и константу диссоциации продукта гидролиза (Fe(OH)2+)
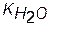
KГ = ¾¾
KД
При гидролизе по аниону (соль MeAn, образованная слабой кислотой и сильным основанием)
Ann- + H2O = HAn(n-1)- + OH-
рН=14 + 1/2lg(KГ[MeAn]0)
Вывод этой формулы дан ниже.
Примером соли, образованной сильным основанием и слабой кислотой может служить сода
Na2CO3 + 2H2O = 2NaOH + H2CO3 гидролиз соды
Моющие свойства соды основаны на том, что при ее гидролизе раствор становится щелочным. Эта реакция является результатом сложения двух реакций:
Na2CO3 + H2O = NaOH + NaHCO3 первая ступень гидролиза
NaHCO3 + H2O = NaOH + H2CO3 вторая ступень гидролиза
При многоступенчатом гидролизе основной вклад в рН раствора вносит первая ступень.
Для реакции гидролиза
Ann- + H2O = HAn(n-1)- + OH-
константа гидролиза есть
[HAn(n-1)-]×[ОH-]
KГ = ¾¾¾¾¾ ¾¾
[Ann-]
Имеем одно уравнение с 3 неизвестными.
Первое недостающее уравнение получим, если учтем, что из-за гидролиза концентрация анионов в растворе уменьшается на х
[Ann-]=[Ann-]0 - х
При этом возникают частицы HAn(n-1)- и OH- в равных концентрациях, т.е. [An(n-1)-]=[OH-].
Поэтому выражение для константы гидролиза (при [Ann-]0 >> х) принимает вид
[ОH-]2
KГ = ¾¾¾
[Ann-]0
откуда получаем
[ОH-]=(KГ [Ann-]0)1.2
а с учетом ионного произведения воды
[H+]= 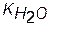 /[OH-]=
/[OH-]= 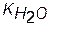 /(KГ [Ann-]0)1.2
/(KГ [Ann-]0)1.2
Из этого уравнения получается искомое уравнение
рН=14 + 1/2lg(KГ[MeAn]0)
т.к. из-за полной диссоциации соли [Ann-]0= [МеAn]0.
8. Расчет рН-гидратообразования.
Рассмотрим химическое равновесие для реакции образования малорастворимого основания
Men+ + nOH- = MeOH¯
Для этой реакции закон действующих масс принимает вид
K = ¾¾¾¾¾
[Меn+][OH-]n
т.к. по соглашению принимается, что для веществ, образующих самостоятельную фазу, концентрация равна 1 ([MeOH]кр=1).
Из этого уравнения следует, что произведение концентраций ионов металла и гидроксила при равновесии должно оставаться постоянной величиной, которую назвали произведением растворимости
ПР= [Меn+][OH-]n
То значение рН, которое отвечает химическому равновесию для реакции образования малорастворимого основания назвали рН-гидратообразования.
Определим эту величину. Из уравнения для ПР следует
[OH-]=(ПР/[Меn+])1/n
Следовательно
[H+]= 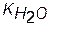 /[OH-]=
/[OH-]= 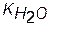 /(ПР/[Меn+])1/n
/(ПР/[Меn+])1/n
Отсюда получаем искомое выражение
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1013; Нарушение авторских прав?; Мы поможем в написании вашей работы!