
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Устройство и работа медно-цинкового и марганцево-цинкового гальванических элементов
|
|
|
|
Примером химического гальванического элемента может служить элемент Якоби-Даниэля (рис. 6). Он состоит из медного электрода (медной пластинки, погруженной в раствор CuSO4) и цинкового электрода (цинковой пластинки, погруженной в раствор ZnSO4). На поверхности цинковой пластинки возникает ДЭС и устанавливается равновесие
Zn ⇄ Zn2+ + 2ē
При этом возникает электродный потенциал цинка, и схема электрода будет иметь вид Zn|ZnSO4 или Zn|Zn2+.
Аналогично, на медной пластинке также возникает ДЭС и устанавливается равновесие
Cu ⇄ Cu2+ + 2ē
Поэтому возникает электродный потенциал меди, и схема электрода будет иметь вид Cu|CuSO4 или Cu|Cu2+.
На Zn-электроде (электрохимически более активном), протекает процесс окисления: Zn – 2ē →Zn2+. На Cu-электроде (электрохимически менее активном) протекает процесс восстановления: Cu2+ + 2ē → Cu.
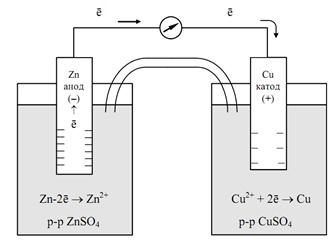
Рис. 6 Схема медно-цинкового гальванического элемента
Суммарное уравнение электрохимической реакции:
Zn + Cu2+ → Zn2+ + Cu
или Zn + CuSO4 → ZnSO4 + Cu
Поскольку схема химического гальванического элемента записывается по правилу «правого плюса», то схема элемента Якоби–Даниэля будет иметь вид
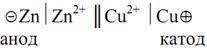
Двойная черта в схеме обозначает электролитический контакт между электродами, осуществляемый обычно посредством солевого мостика.
В марганцево-цинковом гальваническом элементе (рис. 7), как и в медно-цинковом, анодом служит цинковый электрод. Положительный электрод прессуется из смеси диоксида марганца с графитом и ацетиленовой сажей в виде столбика «агломерата», в середине которого помещается угольный стержень ‑ токоотвод.
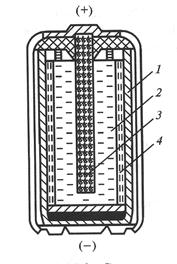
Рис. 7 Схема сухого марганцево-цинкового элемента
|
|
|
1 – анод (цинковый стаканчик), 2 – катод (смесь диоксида марганца с графитом), 3 – токоотвод из графита с металлическим колпачком,
4 - электролит
Применяемый в марганцово-цинковых элементах электролит, содержащий хлорид аммония, вследствие гидролиза NH4CI имеет слабокислую реакцию. В кислом электролите на положительном электроде идет токообразующий процесс:
МnO2 + 4Н+ + 2ē → Мn2+ + 2Н2O
В электролите с рН равным 7-8 ионов водорода слишком мало и реакция начинает протекать с участием воды:
МnО2 + H2O + ē → MnOOH + ОН-
МnООН — это неполный гидроксид марганца (III) – манганит.
По мере расходования ионов водорода на токообразующий процесс электролит становится из кислого нейтральным или даже щелочным. Удержать кислую реакцию в солевом электролите при разряде элементов не удается. Добавить кислоту к солевому электролиту нельзя, так как это вызовет сильный саморазряд и коррозию цинкового электрода. По мере накопления на электроде манганита он частично может реагировать с ионами цинка, образующимися при разряде цинкового электрода. При этом получается труднорастворимое соединение ‑ гетаэролит, и раствор подкисляется:
2MnOOH + Zn2+ → ZnO∙Мn2O3 + 2Н+
Образование гетаэролита предохраняет электролит от слишком сильного подщелачивания при разряде элемента.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 955; Нарушение авторских прав?; Мы поможем в написании вашей работы!