
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состав и строение атомов
|
|
|
|
Энергия кристаллической решетки. Методы ее определения.
Состав и строение атомов.
2. Строение вещества и типы химических связей
3. Атомные и ионные радиусы, закономерности их изменения. Координационное число. Явление поляризации.
Кристаллохимия – наука, которая изучает функциональные связи между химическим составом твердых кристаллических тел и их физическими свойствами, включая выяснение зависимости между химическим составом и кристаллической структурой вещества, т.е. способом расположения атомов (ионов) и их комплексов в решетке.
Геохимия как наука занимается изучением поведения и распространения химических элементов в Земле. Поведение элементов на Земле определяется, в первую очередь, химическими и физическими свойствами их атомов. Распространенность элементов в Земле и в космосе связано со строением и устойчивостью ядер атомов. Миграция же атомов, их способность к перемещению, определяется, главным образом, строением внешних электронных оболочек.
В 1911 г. Резерфордом предложена планетарная модель атома, на основе которой в 1913г. Н.Бор положил начало разработки квантовой теории атома.
С точки зрения современных научных представлений, атом является очень сложной системой. Доказано существование следующих элементарных частиц – электронов, протонов, позитронов, нейтронов, мезотронов, нейтрино. В атоме различают 2 части – положительное ядро, состоящее из протонов и нейтронов и отрицательные оболочки, состоящие из электронов. Остальные элементарные частицы образуются при ядерных превращениях. Атом в целом нейтрален.
Масса электронов очень мала по сравнению с массой протонов и нейтронов, поэтому можно считать, что почти вся масса атома практически заключена в ядре. Массы:
|
|
|
Электрон=9,106х10-28г
Протон, нейтрон=1,67х10-24г
Простейшим является атом водорода, ядро которого состоит из одного протона, а так как атом нейтрален, в нем имеется лишь 1 электрон.
После того, как был выяснен состав атома водорода, были предприняты многочисленные попытки построить модель, которая объясняла бы его химические и физические свойства. Н.Бором была предложена теория строения атома, которая предполагает вращение электронов вокруг ядра по определенным стационарным орбитам, удовлетворяющим некоторым квантовым условиям, которые и были им сформулированы.
В нормальном состоянии атома водорода устойчивой является первая круговая орбита, по которой электрон вращается вокруг протона. Этой орбите отвечает уровень энергии электрона К. Если электрону сообщить квант энергии hn (где h постоянная Планка, n - частота поля энергии), то электрон перейдет на следующую орбиту, с уровнем энергии L, причем он может вращаться или по круговой, или по эллиптической орбите. Если сообщить электрону еще один квант энергии hn, электрон перейдет на еще более высокий уровень энергии M, для которого возможны уже три орбиты: круговая и две эллиптические. Таким же образом для уровня энергии N получается 4 орбиты и т.д. для уровней O, P и далее.
Было установлено, что число электронов, вращающихся вокруг ядра, равно порядковому номеру элемента в таблице Менделеева – правило Мозелея.
У гелия 2 электрона, причем оба они вращаются по круговым орбитам с запасом энергии К. Тип строения атома гелия выражается схемой:
| ядро |
У лития 3 электрона: два на уровне К, 1 – на уровне L:
| ядро |
У бериллия 4 электрона: 2 на уровне К, 2 – на уровне L:
| ядро |
При переходе к каждому последующему элементу происходит нарастание слоя орбит с энергией L до 8. У натрия (№11) – два электрона на уровне К, восемь – на уровне L, один внешний электрон на уровне М:
|
|
|
| ядро |
До №18 аргона (включительно) идет заполнение уровня М. Затем заполняются уровни N,O,P.
В каждой оболочке (отвечающей определенному уровню) может быть только определенное число электронов, которое не больше, чем 2n2, где n – номер оболочки: в K-оболочке – не больше 2, в L-оболочке – не больше 8, в M-оболочке – 18, в N-оболочке – 32 и т.д.
Для К=2*12=2
Для L=2*22=8
Для M=2*32=18
Для N=2*42=32
Для O=2*52=50
Если внешние оболочки состоят из 8 электронов, то имеем благородные газы:
№2 – гелий (He)
| ядро |
№10 – неон (Ne)
| ядро |
№18 – аргон (Ar)
| ядро |
№36 – криптон (Kr)
| ядро |
№54 – ксенон (Xe)
| ядро |
№86 – радон (Rn)
| ядро |
Такие системы наиболее прочные.
Правило Косселя: атомы всех элементов стремятся при подходящих условиях перейти в эти наиболее прочные системы, т.е. образовать внешнюю оболочку из 8 электронов.
Этим обусловливается валентность атомов, проявляющаяся при переходе их в ионы.
Например, Na при переходе к типу ближайшего благородного газа – Ne должен потерять 1 электрон, получается одновалентный катион натрия – Na+ (Na+Cl- - галит); Mg для этой же цели должен терять 2 электрона Mg2+ (KC1*MgCl2*6H2O– карналлит).
С другой стороны, F,
| ядро |
чтобы приобрести конфигурацию Ne, должен присоединить 1 электрон – получается одновалентный анион фтора F- с 8-электронной внешней оболочкой (CaF2 - флюорит).
Для S со строением атома:
| ядро |
при переходе ее в ионы возможно или присоединение 2 электронов до Ar (здесь S – двухвалентный анион – Pb2+S2- - галенит), или же отдача 6 электронов до Ne (здесь S – шестивалентный катион- Ba2+S6+O42- - барит).
От водорода (№1) до кальция (№20) при переходе от атома одного элемента к атому следующего каждый новый электрон располагается в самой внешней оболочке. Начиная же со Sc и до Ni (а также от Y до Pd (палладия) и от La до Pt) электроны располагаются не в самом внешнем слое, а производят достройку одного из более внутренних слоев. Таким образом, у целых групп элементов наблюдается одинаковое строение внешних валентных оболочек, с одинаковым числом электронов. Подобные группы элементов с достраивающимися электронными оболочками носят название семейств и характеризуются близкими химическими свойствами, поскольку последние зависят, в основном, от внешних валентных оболочек, которые здесь одинаковы. Наиболее характерны:
|
|
|
1. семейство железа, включающее Sc, Ti, V, Cr, Mn, Fe, Co, Ni (у всех в валентном слое N по два электрона, достраивается слой M);
2. семейство редких земель (от La-№57 до Lu-№71) – здесь одинаковое количество 2+1 электронов в оболочках P и O, достраивается третья от периферии оболочка N;
3. семейство актиноидов (от актиния Ac до лоуренсия Lr), аналогичное семейству редких земель.
Близость химических и физических свойств атомов в пределах семейства обусловливает совместное нахождение их в природе (элементы семейства железа – преимущественно в ультраосновных породах, редкие земли – в гранитных пегматитах и в щелочных породах и др.). Сходством в строении электронных оболочек объясняются также близкие химические свойства и совместное нахождение в природе элементов платиновой группы.
Химические свойства атомов зависят от прочности связи внешних валентных электронов. Это проявляется в способности атомов к ионизации, в их химической активности, т.е. способности вступать в соединения, в окислительных и восстановительных их свойствах и др.
Ядро состоит из протонов и нейтронов = нуклоны. Число протонов в ядре равно порядковому номеру элемента в периодической системе Менделеева Z. Сумма числа протонов Z и числа нейтроно N в ядре называется массовым числом (массовым номером ядра) А: А= N+Z. Массы протона и нейтрона близки друг к другу, и каждая из них приблизительно равна атомной единицы массы, пример:
N А
20,22,23,24,2620Са40,42,43,44,46
Z
Изотопы – атомы, заряды ядер которых одинаковы, а массы разные. Количество изотопов гораздо больше количества самих элементов: ртуть – 7, олово – 10.
пример:
N А
20,22,23,24,2620Са40,42,43,44,46
Z
В изотопах Z – постоянно, N и A – переменно.
Изобары – атомы с разным числом протонов, но с одинаковым массовым числом. В изобарах А постоянно, Z и N – переменны. Пример:
|
|
|
46Ве10 – 55В10 – 64С10
Изотоны – атомы с разным числом протонов и разными массовыми числами, но с одинаковым числом нейтронов. В изотонах N – постоянно, и A и Z – переменны. Пример:
57В12 – 67С13 - 77 N14 – 87О15
Структура атомных ядер остается одной из сложнейших проблем современной физики. Существует несколько моделей атомных ядер: «жидкой капли», ферми-газа и др. Согласно широко распространенной оболочечной модели, каждый нуклон в ядре находится в определенном квантовом состоянии и располагается на отвечающем этому состоянию энергетическом уровне. Эти уровни, подобно электронным уровням атома, могут заполняться определенным числом нуклонов.
Ядра, в которых полностью заполнены уровни с числом нейтронов 2,8,14,20,28,50,82 126 или с числом протонов 2,8,14,20,28,50,82 называются магическими. Элементы, имеющие ядра с дважды магическими числами (нейтронов и протонов)=2Не4, 8О16, 14Si28, 82Pb208 отличаются наибольшой стабильностью.
Элементы с магическими числами протонов – 20Са, 50Sn, 82Pb – имеют наибольшее число изотопов. Элементы, отвечающие магическому числу нейтронов, обладают наибольшими внутриядерными связями: 54Хе136.
Начиная с полония все более тяжелые элементы обладают радиоактивностью. Ядра их непрерывно разрушаются, испуская альфа-частицы (ядра гелия), либо бета-частицы (электроны), либо гамма-излучение. При этом уменьшается массовое число образующихся изотопов до тех пор, пока не возникнет стабильное ядро изотопа – конечный продукт распада одного из радиоактивных семейств:
U238 → Pb206, U235 → Pb207, Th232 →Pb208, Np237 →Bi209.
Первоначальное представление о строении ядер, исходившее из строгого равенства масс ядер водорода и протонов в ядрах других элементов, оказалось в противоречии с экспериментальными данными. Эта разница между экспериментально измененной массой атома (масс-спектрометрия) и расчетной называется дефектом массы.
Следует отметить, что масса атомов выражается в атомных единицах массы – а.е.м. Различают химическую а.е.м. – х.а.е.м.=1/16 средней атомной массы изотопов кислорода (О16, О17, О18)=1,66022х10-24г и унифицированную=1/2 ядра С12=2,66057х10-24г.
2. Строение вещества и типы химических связей
Основной формой нахождения химических элементов в земной коре являются твердые тела – минералы, которые слагают горные породы и месторождения рудных и нерудных полезных ископаемых. Свойства минералов определяются их химическим составом, а также расположением и свойствами слагающих их единиц – ионов, атомов или их комплексов.
В основном, вещество земной коры – это соединения элементов, образующих кристаллические решетки. В этих решетках могут быть 4 вида химический связей.
1. ионная связь (гетерополярная)- наблюдается в типичных ионных кристаллах (например, в решетке галита – связь между ионами натрия и хлора). Характер ионный связей объясняется следующим образом: нейтральные атомы стремятся к устойчивости 8-электронной конфигурации внешней оболочки. В результате, одни из них – металллы (например, натрий в галите) – теряют электроны, превращаясь в положительные катионы; другие – металлоиды (хлор) – приобретают эти электроны, переходя в отрицательные анионы. Катионы и анионы притягиваются друг к другу по закону Кулона, образуя ионные кристаллические решетки.
Способность атома присоединять чужой электрон для образования более прочного соединения называется электроотрицательностью.
Поваренных А.С. вычислил величины электроотрицательности и установил, что чем больше разница электроотрицательности двух элементов, образующих соединения, тем боле ионной оказывается связь между ними. Чем меньше – тем более выражена атомная связь.
2. атомная (гомополярная, ковалентная) связь – характерна для газовых молекул H2, O2, N2, F2, Cl2, HCl, HBr, SiF4, CO2 и других, а также для большинства органических соединений. Эти связи объясняются тем же стремлением атомов к устойчивой конфигурации благородных газов. При таком стремлении получаются 1, 2 или 3 пары общих электронов, чем и осуществляется связь. Электронные орбиты двух гетерополярно связанных атомов не имеют точек соприкосновения, орбиты же ковалентно связанных атомов переплетаются.
3. молекулярная (вандерваальсовская, остаточная) связь – существует в молекулярных решетках (связь между молекулами). Она объясняется наличием диполей в электрически нейтральных молекулах.. Эти силы наиболее слабые. Этим объясняют низкие температуры плавления и кипения типичных молекулярных соединений, таких как CO2, SiF4, SnF4 и др.
4. металлическая связь – характерна для металлов (некоторые сульфиды, арсениды, самородные элементы и другие соединения). Характерны общие для всех атомов электроны, которые передвигаются свободно и их поведение напоминает поведение газа («электронный газ». Связь осуществляется притяжением между положительно заряженными остовами атомов и всеми коллективизированными электронами. Теория «электронного газа» объясняет термические и электрические свойства металлов, в том числе их теплопроводность и электропроводность.
3. Атомные и ионные радиусы, закономерности их изменения. Координационное число. Явление поляризации.
В основе современных кристаллохимических представлений лежит понятие о радиусах ионов и атомов, т.е. представления о том, что ионы и атомы имеют сферическую форму и определенный при данных условиях объем, непроницаемый для других ионов и атомов. В настоящее время принимают, что выполнение пространства атомами или ионами происходит по принципу плотнейшей шаровой упаковки.
При плотнейшей упаковке одинаковые шары занимают 74,05% объема, а остальное пространство остается на пустоты, которые бывают 2 родов: тетраэдрические (между 4 шарами) и октаэдрические (между 6 шарами). В этих пустотах располагаются более мелкие шары (обычно катионы). На каждые n шаров плотнейшей кладки приходится n октаэдрических пустот и 2n – тетраэдрических.
Расстояние между центрами 2-ух соседних шаров можно считать равным сумме радиусов этих соседних шаров (атомов, ионов). На основании рентгеноструктурных измерениц расстояний между атомами (ионами) в кристаллической решетке вычислены радиусы, которые названы, по предложению Гольдшмидта, “эффективными”, и которые сохраняются при вхождении данного атома (иона) в любую кристаллическую решетку.
Величины атомного или ионного радиусов элементов (Ra, Rk, ri), а также валентность (ω) являются важными геохимическими показателями. Радиусы измеряются в ангстремах: 1Ао=10-10 м.
Ro2-=1,32Ао
Rk+=1,33Ао
Rs2-=1,74Ао.
Закономерности изменения ионных радиусов в периодической системе Менделеева:
1. В горизонтальном направлении, т.е. по периодам, радиусы ионов уменьшаются с увеличением заряда (валентности) ионов. Например, для натрия (+) радиус иона равен 0,98, магния (2+) – 0,78, алюминия (3+) – 0,57Ао.
2. В вертикальном направлении радиусы ионов увеличиваются сверху низ, т.е. с увеличением порядкового номера: литий(+)- 0,78, натрий(+) = 0,98, калий(+) – 1,33Ао.
3. В направлении диагоналей, проведенных через катионы слева сверху направо вниз радиусы ионов близки или равны по размерам (правило диагональных рядов А.Е.Ферсмана): литий 0,78 – магний 0,78 – скандий 0,83; натрий(098) – кальций(1,06) 0 иттрий (1,06).
4. для радиусов катионов одного и того же элемента, имеющего переменную валентность, размеры ионов уменьшаются с увеличением заряда: марганец(2+) – 0,91; марганец (3+) – 0,70; марганец(4+) – 0,52.
5. радиусы анионов, в целом, значительно больше радиусов катионов. Для анионов они почти все находятся в пределах 1,3-2,2, для катионов – 0,1-1,7.
6. Если элемент может быть и катионов и анионов, то радиус катиона намного меньше, а радиус аниона всегда больше радиуса атома:
S6+=0,34 < So=1,04 < S2-= 1,74
сульфаты атом сульфиды
7. На фоне закономерного изменения размеров радиусов ионов в пределах периодической таблицы наблюдается явление сжатия радиусов у лантаноидов, т.е. уменьшение радиусов ионов с увеличением порядкового номера в ряду трехвалентных элементов редких земель (3 группа) от лантана (радиус=1,22) до лютеция (0,99), что приводит к почти полному совпадению радиусов у иттрия (0,92) и Но (0,91); у элментов 4 группы – циркония (0,70) и гафния (0,78), а также в 5 группе – ниобия (0,69) и тантала (0,68).
Явление «лантаноидного сжатия» заключается в нарушении правила уменьшения ионных радиусов одной и той же Менделеевской группе, если эти ионы разделены строкой с редкоземельными элементами – лантаноидами. В самой строке происходит постепенное уменьшение радиусов от лантана до лютеция, которое приводит к почти полному совпадению ражиусов у иттрия и Но и т.д.
Эффективные радиусы ионов не являются строго постоянными величинами, а несколько изменяются при переходе от решеток одного типа к решетке другого типа, т.е. в зависимости от координационного числа.
Координационным числом данного иона (атома) называют число соприкасающихся с ним ионов (атомов) другого элемента, одинаково расположенных в кристаллической решетке по отношению к данному. Например, галит: каждый ион натрия окружен 6 ионами хлора, расположенных по углам октаэдра, значит, координационное число для иона натрия – 6. То же самое число будет в этой решетке и для иона хлора, т.к он также окружен 6 ионами натрия, расположенных по углам октаэдра.
В силикатах и кварце, где каждый ион кремния окружен 4 ионами кислорода, координационное число кремния=4, а кислорода, который имеет только 2 соседних иона кремния = 2.
Уменьшение координационного числа иона ведет и к уменьшению радиуса и наоборот. Следовательно, для одних и тех же пар ионов в решетках с различными координационными числами, расстояние между центрами ионов будет больше в случае высоких и меньше – в случае низких координационных чисел. Определяют координационное число по отношению радиуса катиона к радиусу аниона.
Мы рассматриваем ионы (атомы), слагающие кристаллические решетки, как несжимаемые шары. В действительности, электронные оболочки могут под влиянием зарядов ионов менять свои размеры и форму. Это явление объясняется поляризацией, т.е. воздействием электрических полей одних ионов (атомов) на электронные оболочки других.
Поляризация – это искажение электронного облака крупного катиона малым анионом. Катион притягивает анион, сам входит в электронное облако аниона и уменьшает его ионный радиус. Поляризация тем сильнее, чем больше разница в радиусах и валентности ионов. Следовательно, поляризация происходит при воздействии электрических полей катионов и анионов. Можно при этом говорить как о способности ионов деформироваться (пассивная поляризация), так и о способности их деформировать соседние с ними частицы (активная поляризация). Пассивная поляризация особенно велика у ионов с большими радиусами и малыми зарядами (валентностями), активная – для ионов с большими зарядами и малыми радиусами. Здесь главную роль играет заряд, который определяет напряжение электрического поля.
Сильное сокращение расстояний между ионами под влиянием поляризации приводит в отдельных случаях к образованию комплексных анионов: (SO4)2-, (CO3)2-, (NO3)- и др.
Выводы:
1. при одном и том же заряде способность иона к поляризации сильно возрастает с увеличением ионного радиуса. Поэтому особенно сильно поляризуются анионы по сравнению с катионами, т.к. их радиусы больше.
2. Увеличение валентности катионов сопровождается уменьшением коэффициента поляризации. Этот связано с параллельным уменьшением радиусов ионов и в меньшей степени, с ростом заряда.
3. Сильно поляризуются низковалентные ионы с большими радиусами, слабо поляризуются мелкие ионы с большими зарядами. Следовательно, особенно сильно будут поляризовываься, например, ионы йода, брома, серы и цезия.
4. Энергия кристаллической решетки. Методы ее определения
Многие ученые обращали внимание на исключительную роль для понимания геохимических процессов электрических зарядов ионов (их валентностей) с одной стороны, и их размеров (радиусов) – с другой. Синтезом этих 2 направлений явилась геоэнергетическая теория А.Е.Ферсмана, сформулированная в 1934 году. За основу геоэнергетических построений была принята энергия кристаллической решетки. Эта энергия является функцией зарядов ионов и их радиусов и измеряется работой, которую необходимо затратить, чтобы разорвать грамм-молекулу вещества на составляющие его ионы. Энергию кристаллической решетки можно определять опытным и теоретическим путем.
В термохимии давно установлена связь устойчивости химических соединений с теплотой их образования – наибольшей стойкостью обладают те соединения, образование который сопровождается наибольшим выделением теплоты.
Следовательно, для соединений, образующихся их ионов, мерой стойкости будет энергия кристаллической решетки, поскольку эта энергия, в основном, определяет тепловой эффект данной реакции.
Знание энергии кристаллических решеток природных соединений позволяет решить ряд геохимических проблем, связанных с распределением элементов между различными фазами процессов, с их накоплением и рассеянием, образованием ассоциаций и др., т.е. в общем виде проследить судьбу химического элемента на различных этапах его истории в земной коре. Знание ЭКР необходимо для объяснения многочисленных процессов минералообразования из растворов и расплавов (о последовательности образования минералов, о их парагенетических ассоциациях и др.).
1. Впервые формула для вычисления ЭКР была выведена Н.Борном в 1919 году для бинарных соединений.
 где
где
w1, w2 – валентности;
rk, ra – радиусы катионов и анионов в ангстремах;
a – уоэффициент Маделунга, значение которого зависит от характера расположения ионов в пространстве (для галита – 1,7475);
293 – константа, учитывающая коэффициент отталкивания, число Авогадро, заряд электрона.
2. Формула Капустинского А.Ф. (1933). Он показал, что из формулы Борна можно исключить коэффициент Маделунга, но ввести число ионов в молекуле. По этой формуле можно вычислить энергию не только бинарных соединений с известной структурой, но и таких соединений, структура которых не известна.
 где
где
w1, w2 – валентности;
rk, ra – радиусы катионов и анионов в ангстремах;
∑n – количество ионов в соединении;
256,1 – константа.
3. А.Е.Ферсман создал систему энергетических коэффициентов (ЭК), которые позволяют вычислять энергию кристаллической решетки любых соединений с большой точностью.
ЭК – это пай энергии, который вносит каждый ион в гетерополярное соедиенние при его образовании из ионов, находящихся в бескоенчности.
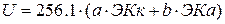 где
где
а и в- числа катионов и анионов в молекуле;
256,1 – коэффициент Капустинского, который при соответствующем масштабе эков дает выражение энергии в ккал на грамм-молекулу вещества.
Для более сложных соединенийприменение принципа аддитивности приводитк общему выражению:
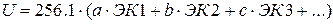 , где
, где
Лекция 4
Ізоморфізм мінералів, його види і прояви,
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1228; Нарушение авторских прав?; Мы поможем в написании вашей работы!