
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кінетика
|
|
|
|
ІІІ рівень
1. Окислення глюкози процес, що має важливе значення для забезпечення організму енергією здійснюється складним шляхом, однак згідно наслідку із закону Гесса, цей процес можна виразити рівнянням: С6Н12О6 + О2 → 6СО2 + 6Н2О.
Для даної реакції, виходячи із стандартних термодинамічних значень:
- Обчислити ентальпію (∆Н0298) реакції і зробити висновок про тепловий ефект реакції:
а) ∆Н = -2803,9 кДж/мольК – реакція екзотермічна;
б) ∆Н = -3645,1 кДж/мольК – реакція ендотермічна;
в) ∆Н = 458 кДж/мольК – реакція екзотермічна;
г) ∆Н = 836,1 кДж/мольК – реакція ендотермічна.
2) Обчислити ентропію (∆Ѕ298) реакції і зробити висновок про ймовірність даного процесу:
а) ∆Ѕ = 260,1 Дж/моль К – процес імовірний;
б) ∆Ѕ = 350,1 Дж/моль К – процес неімовірний;
в) ∆Ѕ = -90,5 Дж/моль К – процес імовірний;
г) ∆Ѕ = -546,1 Дж/моль К – процес неімовірний;
3. Визначити енергію Гіббса для реакції:
а) ∆G = -2726,4 кДж/моль;
б) ∆G = -4815,1 кДж/моль;
в) ∆G = 591,5 кДж/моль;
г) ∆G = 987,6 кДж/моль.
4. Вибрати при якому співвідношенні термодинамічних функцій можливе самовільне протікання реакції:
а) ∆G < 0; ∆Н < 0; ∆S > 0;
б) ∆G < 0; ∆Н > 0; ∆S > 0;
в) ∆G > 0; ∆Н < 0; ∆S < 0;
г) ∆G = 0; ∆Н > 0; ∆S < 0.
5) Розрахуйте, скільки енергії виділяється при окисленні 1 г глюкози:
а) 15,5 кДж/г;
б) 25,8 кДж/г;
в) 50,1 кДж/г;
г) 120,1 кДж/г.
| Н2О (р) | СО2 (г) | С6Н12О6 | О2 (г) | |
| ∆Н0298 кДж/моль | -286,02 | -393,7 | -1274,4 | |
| ∆S0298 кДж/моль | 213,8 | 212,1 | 205,1 |
2. Окислення сахарози процес, що має важливе значення для забезпечення організму енергією здійснюється складним шляхом, однак згідно наслідку із закону Гесса, цей процес можна виразити рівнянням: С12Н22О11+ 12О2 → 12СО2 + 11Н2О.
|
|
|
Для даної реакції, виходячи із стандартних термодинамічних значень:
1) Обчислити ентальпію (∆Н0298) реакції і зробити висновок про тепловий ефект реакції:
а) ∆Н = -2803,9 кДж/мольК – реакція екзотермічна;
б) ∆Н = -3645,1 кДж/мольК – реакція ендотермічна;
в) ∆Н = -5650,69 кДж/мольК – реакція екзотермічна;
г) ∆Н = 836,1 кДж/мольК – реакція ендотермічна.
2) Обчислити ентропію (∆Ѕ298) реакції і зробити висновок про ймовірність даного процесу:
а) ∆Ѕ = 260,1 Дж/моль К – процес імовірний;
б) ∆Ѕ = 2978,02 Дж/моль К – процес неімовірний;
в) ∆Ѕ = -90,5 Дж/моль К – процес імовірний;
г) ∆Ѕ = -546,1 Дж/моль К – процес неімовірний;
3. Визначити енергію Гіббса для реакції:
а) ∆G = -2726,4 кДж/моль;
б) ∆G = -4815,1 кДж/моль;
в) ∆G = 591,5 кДж/моль;
г) ∆G = -5817,5 кДж/моль.
4. Вибрати при якому співвідношенні термодинамічних функцій можливе самовільне протікання реакції:
а) ∆G < 0; ∆Н < 0; ∆S > 0;
б) ∆G < 0; ∆Н > 0; ∆S > 0;
в) ∆G > 0; ∆Н < 0; ∆S < 0;
г) ∆G = 0; ∆Н > 0; ∆S < 0.
5) Розрахуйте, скільки енергії виділяється при окисленні 5 г сахарози:
а) 15,5 кДж/г;
б) 25,8 кДж/г;
в) 50,1 кДж/г;
г) 359,82 кДж/г.
| Н2О (р) | СО2 (г) | С12Н22О11 | О2 (г) | |
| ∆Н0298 кДж/моль | -286,02 | -393,7 | -2220,867 | |
| ∆S0298 кДж/моль | 213,8 | 359,82 | 205,1 |
1. Яке з наведених нижче рівнянь визначення швидкості є правильним для реакції: А+2В=АВ2?
а) v = k∙∙ [А] ∙ [В] б) v = k ∙ [A]2 ∙ [B] в)v = k ∙ [A] ∙ [B]2 г)v = k ∙ [A]2 ∙ [B]2.
2. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при зниженні температури: N2+3H2↔2NH3+Q?
а) не зміниться; б) зміститься вправо; в) зміститься вліво;
г)температура не впливає на стан рівноваги цього процесу.
3. Як зміниться стан хімічної рівноваги при підвищенні тиску такого процесу:
2NO+O2 ↔2NO2, ∆Н=-78кДж/моль?
а) не зміниться; б) прискориться прямий процес; в) прискориться зворотній процес;
г) спочатку зменшиться швидкість прямого процесу, а потім збільшиться.
|
|
|
4. У реакції С(т)+О2(г)=СО2(г) тиск збільшили в 4 рази. Як зміниться при цьому вихід СО2?
а) зросте в 4 рази; б) зросте у 8 разів; в) не зміниться; г) зменшиться вдвічі.
5. Рівновага реакції розкладу NO2 за реакцією 2NO2↔ 2NO+O2 встановилася при концентраціях (моль/л): [NO2] = 0,02; [NO] = 0,08; [O2] =0,16. Обчисліть константу рівноваги цієї реакції, відповідь підтвердіть розрахунком.
а) 1,28 б) 0,64 в) 2,56 г)1,92.
6. У скільки разів зросте швидкість реакції 2СО+О2=2СО2, якщо температура збільшилася з 900 до 120оС (γ=3)? Наведіть розрахунок.
а) у 12 разів; б) у 27 разів; в) у 81 раз; г) у 9 разів.
7.З підвищенням тиску концентрація газуватих речовин у реакційній суміші:
а).не змінюється; б)збільшується; в)зменшується;
г)тиск не впливає на концентрацію газів.
8. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при зниженні температури:
СОСІ2 ↔СО+СІ2 –Q?
а) не зміниться; б)зміститься вправо; в)зміститься вліво;
г) зміститься в сторону утворення хлору.
9. Чи відбудуться зміни швидкості рівноважного процесу: 2SO2 (г)+О2(г) ↔ 2SO3 (г); ∆Н=-198 кДж/моль, якщо підвищити тиск у системі?
а) не відбудуться; б) прискориться прямий процес; в) прискориться зворотній процес;.
г) спочатку зменшиться швидкість прямого процесу, а потім збільшиться.
10. У скільки разів збільшиться швидкість реакції з температурним коефіцієнтом (γ=3), якщо температура підвищиться на 30оС?:
а) у 3 рази; б) у 9 разів; в) у 6 рази; г) у 27 разів; д) у 81 разів.
11.Обчислити початкові концентрації хлору і карбон (ІІ) оксиду реакції СО+СІ2 ↔СОСІ2,якщо рівноважні концентрації (моль/дм.3): [СІ2] =0,3; [СО] =0,2; [СОСІ2]=1,5.
а) 1,5СО і 1,5 СІ2; б) 1,7СО і 1,8 СІ2; в) 1,3СО і 1,7СІ2; г)1,8 СО і 1,7 СІ2.
12.Як зміниться швидкість прямої реакції 2SO2+O2↔2SO3, якщо збільшити
концентрацію SO2 в 4 рази? а) не зміниться; б) збільшиться у 8 разів;
в) збільшиться у 4 рази г) збільшиться у 16 разів.
13.Яке співвідношення є константою рівноваги для хімічної рівноваги, описаної рівнянням реакції 2NO+O2↔2NO2 ?
а) 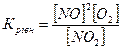 б)
б) 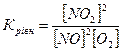 в)
в) 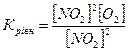
14.Чи зміниться стан хімічної рівноваги в наведеному рівнянні при збільшенні концентрації водню:
H2+S ↔H2S?
а) не зміниться; б) зміститься вправо; в) зміститься вліво; г) зміститься в сторону розкладу H2S.
15.Як зміниться стан хімічної рівноваги в наведеному рівнянні при підвищенні температури
|
|
|
2NO+O2↔ 2NO2, ∆Н=-78кДж| моль?
а) не зміниться; б)спочатку зменшиться швидкість прямого процесу, а потім збільшиться; в)зміститься вправо; г)зміститься вліво; д) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
16. На скільки градусів слід підвищити температуру,щоб швидкість реакції зросла у 8 разів (γ =2);
а) на 40o С; б) на 80o C; в) на 30о С; г) на 20оС; д) на 160оС.
17. Як зміниться швидкість прямої реакції: 2SO2+O2↔2SO3, якщо збільшити концентрацію SO2 в 2 рази? а) збільшиться в 4 рази б) не зміниться в) збільшиться у 8 разів г) збільшиться у 2 рази д) збільшиться у 16 разів.
18. Рівноважні концентрації в реакції СО2(г) + Cl2(г) ↔ СOCl2(г) дорівнюють [Сl2] = 0,3моль/дм3;
[СО] = 0,2 моль/дм3; [СОCl2] = 1,2 моль/дм3. Визначіть константу рівноваги:
а) 6; б) 10; в) 12 г) 20; д) 36.
19.Закон діючих мас виражається формулою:
а) 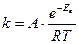 б)
б) 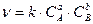 в)
в) 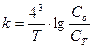 г)
г) 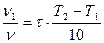
20. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при збільшенні концентрації хлору: Н2 + Cl2 ↔ 2HCl?
а) не зміниться; б) зміситься вправо; в) зміститься вліво;
г) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
21. Як зміниться стан хімічної рівноваги при підвищенні температури такого процесу:
2NO+O2 ↔2NO2, ∆Н=-78кДж/моль?
а) прискориться прямий процес; б) не зміниться; в) прискориться зворотній процес;
г) спочатку зменшиться швидкість зворотного процесу, а потім збільшиться.
22. Чи відбудуться зміни швидкості рівноважного процесу: 2НІ(г) ↔ Н2(г) + І2(г), ∆Н = -198 кДж/моль, якщо збільшити об’єм системи у два рази?
а) не відбудуться; б) прискориться прямий процес;
в) прискориться зворотний процес; г) спочатку зменшиться
23.В скільки разів збільшиться швидкість процесу 2А + В ↔ С, якщо збільшити температуру від 200 до 700 С(γ=3)?
а) у 60 разів; б) у 210 разів; в) у 243 рази; г) у 729 разів; д) у 2187 разів.
24. Рівноважні концентрації речовин в реакції N2 + 3H2 ↔ 2NH3 складають (моль/дм3): [N2] = 4;
[H2] = 9; [NH3] =6. Які були початкові концентрації вихідних речовин?
а) [N2] = 8, [H2] = 16; б) [N2] = 4; [H2] = 20;
в) [N2] = 9; [H2] = 18; г) [N2] = 7; [H2] = 18; д) [N2] = 10; [H2] = 16.
|
|
|
25.Стан хімічної рівноваги констатує:
а) ν прямої > ν зворотної; б) ν зворотної > ν прямої; в) ν прямої = ν зворотної.
26. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при підвищенні тиску: Н2 + І2↔2НІ?
а) не зміниться; б) зміститься вправо; в) зміститься вліво.
27.Яке з наведених нижче тверджень є вірним:
а) каталізатори не беруть участі в реакції;
б) каталізатори беруть участі в реакції, знижуючи енергію активації;
в) каталізатор входить до складу продуктів реакції;
г) каталізатор не входить до складу продуктів реакції. 
28. Чи зміниться стан хімічної рівноваги у наведеному рівнянні при зниженні температури:
COCl2 ↔ CO + Cl2 – Q?
а) не зміниться; б) зміститься вправо; в) зміститься вліво;
г) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
29. В скільки разів збільшиться швидкість реакції N2O4 ↔ 2NO2, якщо температура зросла на 400С (γ=3)?
а) у 12 разів; б) у 9 разів; в) у 27 разів; г) у 81 раз; д) у 243 рази.
30 Обчислити початкові концентрації хлору і карбон (ІІ) оксиду реакції СО+СІ2 ↔СОСІ2, якщо рівноважні концентрації (моль/дм.3): [СІ2] =0,3; [СО] =0,2; [СОСІ2]=1,5.
а) 1,5СО і 1,5 СІ2; б) 1,7СО і 1,8 СІ2; в) 1,3СО і 1,7СІ2; г)1,8 СО і 1,7 СІ2.
31. З підвищенням тиску концентрація газуватих речовин у реакційній суміші:
а).не змінюється; б)збільшується; в)зменшується;
г)тиск не впливає на концентрацію газів.
32.Який вираз константи рівноваги відповідає системі:
Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г)
а) 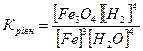 б)
б) 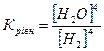 в)
в) 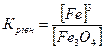 г)
г) 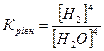
33. Чи зміниться стан хімічної рівноваги в наведеному рівнянні при зменшенні концентрації кисню:
3O2 ↔ 2O3 + Q?
а) не зміниться; б) зміститься вправо; в) зміститься вліво;
г) спочатку збільшиться швидкість прямого процесу, а потім зменшиться.
34. Чому з підвищенням температури відбувається різке збільшенням швидкості реакції?
а) тому, що збільшується швидкість руху молекул;
б) тому, що збільшується концентрація молекул;
в) тому, що збільшується число зіткнень активних молекул.
г) тому, що збільшується тиск у системі.
35. Як зміниться швидкість реакції: 2NO + Cl2 ↔ 2NOCl, якщо збільшити температуру від 1300С до 1800С. Температурний коефіцієнт рівний трьом (γ=3):
а) зросте у 243 рази; б) зросте у 6 разів;
в) зросте у 9 разів; г) зросте у 27 разів; д) зросте у 81 раз.
36. Рівноважні концентрації в реакції СО(г) + Cl2(г) ↔ СOCl2(г) дорівнюють [Сl2] = 0,6моль/дм3;
[СО] = 0,3 моль/дм3; [СОCl2] = 3,6 моль/дм3. Визначіть константу рівноваги:
а) 6; б) 10; в) 12 г) 20; д) 36.
37. Швидкість хімічної реакції, що відбувається в даний момент, тобто за безкінечно малий проміжок часу, дорівнює:
а) 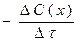 б)
б) 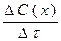
 в)
в) 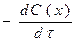 г)
г) 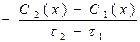
38. Одиницями вимірювання швидкості хімічної реакції є:
а) 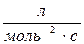 б) с-1
б) с-1  в)
в) 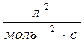 г)
г) 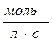
39. Вказати кінетичне рівняння в загальному вигляді для реакцій першого порядку:
а) v = k; б) v = k ∙ [A] ∙ [B] в) v = k ∙ [A]; г) v = k ∙ [A]2 ∙ [B].
40. Вказати кінетичне рівняння в загальному вигляді для реакцій другого порядку:
а) v = k ∙ [A]2 ∙ [B]; б) v = k ∙ [A] ∙ [B] в) v = k ∙ [A]; г) v = k.
41. Вказати кінетичне рівняння в загальному вигляді для реакцій третього порядку:
а) v = k ∙ [A] ∙ [B]; б) v = k ∙ [A]2 ∙ [B] в) v = k; г) v = k ∙ [A].
42. Вказати кінетичне рівняння в загальному вигляді для реакцій нульового порядку:
а) v = k ∙ [A] ∙ [B]; б) v = k ∙ [A]2 ∙ [B] в) v = k; г) v = k ∙ [A].
43. Температурний коефіцієнт Вант-Гоффа для більшості реакцій має значення в межах:
а) 1-2; б)2-4 в)4-6; г) 6-8.
44. Температурний коефіцієнт Вант-Гоффа для більшості біохімічних реакцій має значення в межах:
а) 2-4; б)4-6 в)2-6; г) 7-9.
45. Швидкість хімічної реакції при нагріванні реакційної суміші від 298 К до 338 К, якщо температурний коефіцієнт дорівнює 2, збільшується у:
а) 2 рази; б)4 рази в)8 разів; г) 16 разів.
46. Швидкість хімічної реакції при нагріванні реакційної суміші на 30 К, якщо температурний коефіцієнт дорівнює 3, збільшується у:
а) 3 рази; б)9 разів в)27 разів; г) 81 раз.
47. Швидкість хімічної реакції при підвищенні температури реакційної суміші на 40 К, якщо температурний коефіцієнт дорівнює 2, збільшується у:
а) 2 рази; б)4 рази в)8 разів; г) 16 разів.
48. Швидкість хімічної реакції при підвищенні температури реакційної суміші на 40 К, якщо температурний коефіцієнт дорівнює 3, збільшується у:
а) 3 рази; б)9 разів в)27 разів; г) 81 раз.
49. Якщо при підвищенні температури на 20 К швидкість хімічної реакції збільшилася у 9 разів, то температурний коефіцієнт дорівнює:
а) 2; б) 3 в)4; г) 1.
50. Якщо при підвищенні температури на 20 К швидкість хімічної реакції збільшилася у 9 разів, то температурний коефіцієнт дорівнює:
а) 1; б) 2 в)3; г) 4.
51. Якщо при підвищенні температури на 20 К швидкість хімічної реакції збільшилася у 16 разів, то температурний коефіцієнт дорівнює:
а) 1; б) 2 в)3; г) 4.
52. Якщо при підвищенні температури на 30 К швидкість хімічної реакції збільшилася у 64 рази, то температурний коефіцієнт дорівнює:
а) 1; б) 2 в)3; г) 4.
53. При підвищенні температури швидкість хімічної реакції, як правило, збільшується, тому що:
а) збільшується енергія активації;
б) зменшується енергія активації;
в) збільшується концентрація активних молекул.
г) зменшується концентрація активних молекул.
54. Якщо взаємодія карбон (ІІ) оксиду з хлором описується кінетичним рівнянням V=k[CO][Cl2], то при збільшенні концентрації карбон (ІІ) оксиду в чотири рази, а хлору – у три рази, швидкість реакції збільшиться у:
а) 4 рази; б) 3 рази; в)7 разів; г) 12 разів.
55. Швидкість реакції при 400С дорівнює 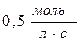 . Швидкість цієї реакції при температурі 800С, якщо γ=3, дорівнює:
. Швидкість цієї реакції при температурі 800С, якщо γ=3, дорівнює:
а) 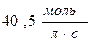 ; б)
; б) 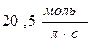 ; в)
; в) 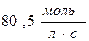 ; г)
; г) 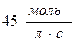 .
.
56. Якщо об’єм реакційної посудини збільшити у 2 рази, то швидкість елементарної реакції
2NO(г) + О2(г)=2NO2(г) зменшиться у:
а) 2 рази; б) 4 рази; в)8 разів; г) 6 разів.
61. Вказати величини, які необхідні для обчислення енергії активації за рівнянням Арреніуса:
а) тільки К1 і К2; б) тільки Т1 і Т2; в) К1, К2, і Т1, Т2; г) тільки К1 і Т1; д) тільки К2 і Т2.
62. При підвищенні температури кількість активних молекул:
а) збільшується; б) зменшується; в)не змінюється; г) спочатку збільшується, а потім зменшується.
63. Каталізатор збільшує швидкість хімічної реакції тому що:
а) зменшує енергія активації;
б) збільшує енергія активації;
в) не впливає на енергію активації.
г) спочатку збільшує, а потім зменшує енергію активації.
64. Інгібітор (каталітична отрута) – речовина, яка в досить незначній кількості:
а) зменшує активність каталізатора;
б) збільшує активність каталізатора;
в) не впливає активність каталізатора.
г) спочатку збільшує, а потім зменшує активність каталізатора.
65. Ферменти (ензими) – біокаталізатори, що мають:
а) вуглеводну природу; б) вуглеводневу природу; в) білкову природу; г) жирову природу.
66. Каталітична активність ферментів у порівнянні зі звичайними хімічними каталізаторами:
а) менша; б) більша; в) значно більша; г) однакова.
67. Активністьферментів залежить від рН. Вказати оптимальні значення рН для шлункового пепсину:
а) 1-2; б)3-4 в)4-6; г) 6-8.
68. Вказати оптимальні значення рН для шлункового трипсину:
а) 1-2; б)3,5-4,5 в)4,5-6,5; г) 7,5-8,5.
69. Активністьферментів залежить від температури. Вказати оптимальні значення температури для більшості ферментів:
а) 30-36; б)37-40 в)40-43; г) 50-60.
70. Залежність швидкості ферментативної реакції від концентрації субстрату описує рівняння:
а) Ареніуса; б)Вант-Гоффа в)Міхаеліса-Ментен; г) Рауля.
71. Який із записів константи хімічної рівноваги для реакції
4HCl(г) + O2(г) ↔T(kt) 2Cl2(г) + 2H2O(г) є вірним:
а) 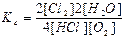 ; б)
; б) 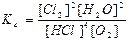
в) 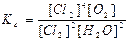 ; г)
; г) 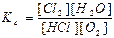 .
.
72. Який із записів константи хімічної рівноваги для реакції
FeO(тв) + СO(г) ↔T FeO(тв) + СО2(г) є вірним:
а) 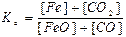 ; б)
; б) 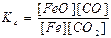
в) 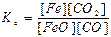 ; г)
; г) 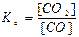 .
.
73. Який із записів константи хімічної рівноваги для реакції
СaCO3(тв) ↔T CaO(тв) + СО2(г) є вірним:
а) 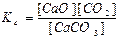 ; б)
; б) 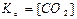
в) 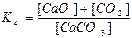 ; г)
; г) 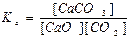 .
.
74. Рівноважним називається такий стан системи, при якому:
а) концентрації реагуючих речовин однакові;
б) швидкості прямої і зворотної реакції рівні, вільна енергія Гіббса досягла мінімального значення;
в) вільна енергія Гіббса дорівнює нулю.
г) вільна енергія Гіббса досягла максимального значення.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2228; Нарушение авторских прав?; Мы поможем в написании вашей работы!