
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Інформаційна частина
Адсорбція ацетатної кислоти на вугіллі
ЛАБОРАТОРНА РОБОТА
САМОСТІЙНА РОБОТА НА ЗАНЯТТІ
ІІІ. Розв’язати задачі
ІІ. Дати письмові відповіді на контрольні запитання
І. Засвоїти основний матеріал навчальної програми
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ ПОЗААУДИТОРНОЇ РОБОТИ
1. Взаємодія на межі розділу фаз Т – Р. Явище змочування. Адгезія і когезія.
2. Термодинаміка поверхневих явищ на межі Т – Р. Робота адгезії і когезії. Теплота змочування.
3. Адсорбція на межі тверде тіло – газ. Загальні положення та основні теорії. Фактори, що впливають на адсорбцію газів і розчинених речовин.
4. Використання рівняння Гіббса, Фрейндліха, Ленгмюра для опису молекулярної адсорбції на межі Т – Р.
5. Теорія полімолекулярної адсорбції (БЕТ, Поляні).
6. Адсорбція на межі тверде тіло – розчин. Молекулярна адсорбція із розчинів. Правило зрівнювання полярностей (П.О. Ребіндер). Гідрофільні і гідрофобні адсорбенти.
7. Обмінна йонна адсорбція із бінарних розчинів. Рівняння ізотерми адсорбції та його частинні випадки.
8. Еквівалентна та вибіркова адсорбція сильних електролітів.
9. Поняття про хроматографію. Класифікація та застосування хроматографічних методів дослідження.
1. Дайте визначення поняттям “адгезія”, “когезія”. Який взаємозв’язок між роботою адгезії та поверхневим натягом?
2. Що характеризує крайовий кут змочування? Як на практиці визначити крайовий кут змочування? Що характеризує теплота змочування?
3. Які обмеження впливають при використанні рівняння Гіббса для дослідження адсорбції з розчинів?
4. Дати визначення правила вирівнювання полярностей Ребіндера.
5. Яка теорія адсорбції містить припущення про утворення полімолекулярних шарів?
6. Що таке «Частокол Ленгмюра»?
7. Які ряди називаються ліотропними, або рядами Гофмейстера?
1. Побудувати графік ізотерми адсорбції в координатах х/m – с, використовуючи експериментальні дані, отримані при вивченні адсорбції оцтової кислоти вугіллям при 25°С.
| с, моль/см3 | 0,018 | 0,031 | 0,062 | 0,126 | 0,268 | 0,471 |
| х/m | 0,467 | 0,624 | 0,801 | 1,11 | 1,55 | 2,04 |
Визначте константи рівняння за Фрейндліхом.
2. Побудувати ізотерму адсорбції карбон (IV) оксиду активованим вугіллям при 231 К і визначити константи емпіричного рівняння Фрейндліха, використовуючи такі експериментальні дані:
| Рівноважний тиск р∙102, Па | 10,0 | 44,8 | 100,0 | 144,0 | 250,0 | |
| Величина адсорбції Г, моль/кг | 0,734 | 1,516 | 2,186 | 2,664 | 3,295 | 4,023 |
1. Контроль та корекція вихідного рівня знань.
2. Виконання лабораторної роботи.
3. Обробка експериментальних даних.
4. Оформлення висновків та протоколів.
Ізотерму адсорбції Фрейндліха (рис. 1.7, а) застосовують частіше, ніж інші ізотерми, хоча вона і має емпіричний характер.
Для виведення рівняння ізотерми Г. Фрейндліх припустив, що кількість адсорбованого газу або твердої речовини, яка припадає на 1 г адсорбенту, пропорційна рівноважному тиску (для газу) або рівноважній концентрації (для твердої речовини). Інакше кажучи, чим вищий тиск або концентрація розчиненої речовини, тим більша кількість речовини адсорбується на поверхні адсорбенту, але пропорційність має не прямий, а експоненціальний характер і виражається емпіричним рівнянням, яке розглядалося у розд. 1:
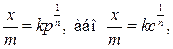
де х – кількість молів адсорбованої речовини; m – маса адсорбенту; р – рівноважний тиск; с – рівноважна концентрація; 1/n – емпіричний показник степеня (його величина лежить у межах 0,1÷0,5) і характеризує ступінь наближення ізотерми до прямої; k – питома адсорбція (якщо р = 1, тоді Г = x/m = k).
Константи 1/n та k залежать від природи адсорбенту та адсорбату. Для їх визначення рівняння Фрейндліха перетворюють логарифмуванням у лінійну форму:
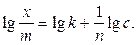
Експериментально визначають величину адсорбції Г = x/m за різних рівноважних тисків p або концентрацій с і будують ізотерму адсорбції в координатах lg x/m – lg p(c). Константи k і 1/n знаходять за графіком (рис. 1.7, б), де відрізок ОА дорівнює lg k, a tga – константі 1/n.
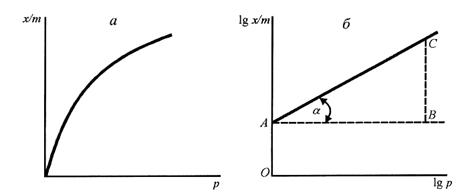
Рис. 1.7. Ізотерма адсорбції (а) та визначення констант рівняння Фрейндліха (б)
Зазначимо: якщо рівняння Ленгмюра описує ізотерму адсорбції в ділянці усіх значень тиску, то рівняння Фрейндліха справджується лише при середніх значеннях тиску. За малих значень тиску, адсорбція зростає прямо пропорційно тиску, тому результати, одержані з рівняння Фрейндліха, будуть занижені. При високих значеннях тиску величина адсорбції не залежить від його величини, тому результати, одержані за рівнянням Фрейндліха, будуть завищені.
|
|
Дата добавления: 2014-11-29; Просмотров: 840; Нарушение авторских прав?; Мы поможем в написании вашей работы!