
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Возгорание и самовозгорание горючего вещества
|
|
|
|
Возгоранием горючего вещества называется возникновение горения под воздействием внешнего источника зажигания. Под источником зажигания понимается горящий предмет или объект, а также электрический разряд с запасом энергии и температурой, достаточными для возникновения горения других веществ. Если возгорание сопровождается появлением пламени, то такой процесс возникновения горения называется воспламенением. Воспламенение хотя и является частным случаем возгорания, однако в реальной действительности имеет наибольшее распространение.
Самовозгорание – процесс возникновения горения при отсутствии источника зажигания. Самовозгорание наблюдается, при резком увеличении скорости экзотермических реакций в объеме вещества, когда скорость выделения тепла превышает скорость его рассеивания. Самовозгорание вещества первоначально происходит в зоне максимальных температур или “горячей” точке, затем горение распространяется по всему объему.
Резкое первоначальное увеличение скорости экзотермических реакций в веществе связано в основном с ростом температуры в зоне реакций под воздействием теплового импульса (при этом температура импульса ниже температуры самовозгорания вещества), микробиологического или химического импульсов. Если самовозгорание сопровождается пламенным горением, то оно называется самовоспламенением.
Процессы воспламенения и самовоспламенения горючего вещества характеризуются соответствующими температурами.
Температура воспламенения - наименьшая температура горючего вещества и материала, при которой от постороннего источника зажигания возникает устойчивое пламенное горение.
|
|
|
Температура самовоспламенения – наименьшая температура горючего вещества и материала, при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся самопроизвольным возникновением пламенного горения.
Следует также отметить температуру вспышки – наименьшую температуру вещества и материала, при которой над его поверхностью образуются пары (газы), способные вспыхивать в воздухе от внешнего источника зажигания; при этом после сгорания части или всего объема парогазовоздушной смеси горение прекращается.
Знание указанных температур важно при оценке в реальных условиях степени пожарной опасности теплового режима обработки различных материалов, условий хранения, эксплуатации. При этом более подробно необходимо остановиться на процессах самовоспламенения, так как они могут привести к неожиданному возгоранию горючих материалов и, как следствие, к возникновению пожара.
В качестве примера рассмотрим самовоспламенение химически однородной горючей системы (смеси горючих газов, паров или пылей с воздухом), находящейся в ёмкости объёмом V. При низкой температуре смеси Тн реакция между горючим веществом и кислородом смеси практически не протекает. Чтобы она началась, нужно смесь подогреть до более высокой температуры То. При определенном значении То начнётся химическая реакция окисления с выделением тепла. Количество выделяемого тепла в единицу времени (называемое скоростью выделения тепла) q1 оценивается по соотношению
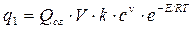 (2.1)
(2.1)
В этом соотношении: Qсг – теплота сгорания горючего вещества, V- объём горючей смеси, k - константа скорости реакции, v - порядок реакции, c - концентрация горючего в смеси, E- энергия активизации, R – газовая постоянная, Т – температура смеси.
При необходимости величина Qсг может быть определена согласно рекомендациям § 1.6,величины V, R считаются известными, величина E – может быть определена, например, согласно рекомендациям [6], величины k, v будут пояснены несколько позже.
|
|
|
Выделившаяся теплота передаётся горючей смеси, и она нагревается. Как только температура смеси превысит температуру внешней среды, начнётся теплоотвод через стенки в окружающую среду. Количество отводимого тепла q2 приближенно принимается пропорциональным разности температур смеси и окружающей среды
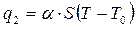 , (2.21)
, (2.21)
где a - коэффициент теплоотдачи от газа стенкам емкости,
S – площадь поверхности стенок емкости,
Т и Т0 – температура смеси и стенок емкости соответственно.
Качественно соотношение значений q1=q1(T) и q2=q2(T) представлено на рис.6.
Система кривых q1', q1'', q1'' ' соответствует различным скоростям химической реакции в зависимости от различных начальных концентраций горючего вещества смеси. При протекании реакции по кривой q1''' вначале вследствие превышения тепловыделения над теплоотводом смесь, начиная с температуры T0,будет разогреваться до температуры TА. Дальнейшее повышение температуры смеси, вызванное самонагреванием, прекратится, так как в точке “А” q1'''= q2, а выше точки “А” q1''' < q2, то есть скорость тепловыделения меньше скорости отвода тепла. Рассматриваемый случай соответствует процессу медленного окисления. В этой области дальнейший разогрев смеси возможен только при внесении тепла извне.
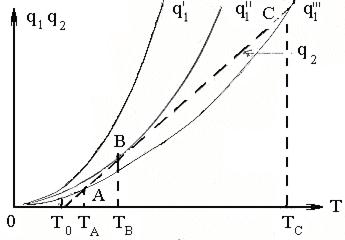
Рис.6. Изменение скорости тепловыделения и теплоотвода при
различных концентрациях горючей смеси
Если смесь окажется разогретой до температуры T > TА, то при естественном процессе смесь вернется в стационарное состояние, характерное для точки “А”. Таким образом, точка “А” характеризует устойчивое стационарное состояние. Если при внесении тепла извне температура смеси превысит ТС , то возможно возгорание смеси. Принято считать, что точка “ С” отражает неустойчивое состояние: при T<Тс самовозгорание (самовоспламенение) смеси не произойдет, при T> Тс – произойдет.
Если реакция протекает по кривой q1', то тепловыделение с самого начала превышает теплоотвод. В этом случае смесь будет непрерывно саморазогреваться, скорость реакции быстро примет высокие значения и в результате в системе произойдёт самовоспламенение, при этом горение смеси возможно в форме взрывного горения.
|
|
|
Граница между областями неограниченного и ограниченного разогрева реагирующей смеси соответствует протеканию реакции по кривой q1''. При этом смесь в начале может саморазогреваться до температуры, при которой наступает тепловое равновесие (точка “В”). Однако в отличие от состояния, характерного для точки “А”, это равновесие неустойчивое. Даже незначительное повышение температуры Т вызовет прогрес-сирующий разогрев смеси, приводящий к самовоспламенению.
Условия перехода рассматриваемой системы к самовоспламенению является касание линии теплоотвода кривой тепловыделения, когда q1''= q2. Температура ТВ этого теплового равновесия является температурой самовоспламенения.
Как отмечалось ранее, система кривых q1', q1''., q1''' на рис.6 соответствует различным скоростям химической реакции в зависимости от различных начальных концентраций горючего вещества в смеси. Для получения представления о роли этого фактора рассмотрим случай, когда молекулы двух реагирующих веществ взаимодействуют друг с другом в соотношении 1:1.
Количественно зависимость скорости химической реакции от концентрации реагирующих веществ определяется открытым в 1867 году законом действия масс [6]. Согласно этому закону скорость химической реакции в рассматриваемом случае определяется по соотношению
v= k [A] [B], (2.3)
где [A]и[B] - концентрации веществ А и В;
k – коэффициент пропорциональности, константа скорости реакции.
В более общем случае скорость реакции m A+ n B = l AB выражается соотношением
v 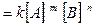 (2.4)
(2.4)
Сумма показателей (m+n) и называется порядком реакции.
Пример. Определить, как изменится скорость реакции 2Н2+О2=2Н2О, протекающей в закрытой емкости, если давление увеличить в 2 раза?
Решение. 1. Обозначим концентрацию Н2 при начальном давлении через С1, а концентрацию О2 через С2; тогда скорость реакции согласно соотношению (2.4) можно представить в виде
v 1 = k С12 С2
2.Находим концентрацию реагирующих веществ, при увеличении давления в 2 раза. Согласно закону Бойля-Мариотта получаем
|
|
|
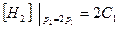 ;
; 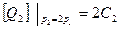
3.Вычисляем скорость реакции в новых условиях
v 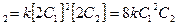
Скорость реакции возрастает в 8 раз.
Таким образом, кривая qI1 на рис.6 отвечает более высокой начальной концентрации горючей примеси в смеси, чем кривая q1II, и тем более чем кривая q1III.
Различают самовозгорание (самовоспламенение) тепловое, микробиологическое и химическое в зависимости от причины выделения тепла в начальной фазе самонагревания веществ и материалов.
Тепловым называется самовозгорание (самовоспламенение), вызванное тепловым самонагреванием, возникшим под воздействием внешнего нагрева вещества.
При исследовании этого процесса выделяют температуру самонагревания, под которой подразумевают самую низкую температуру вещества (смеси), при которой возникает его самонагревание вследствие реакций окисления, разложения и др. Температуру самонагревания обычно определяют экспериментально. Например, температуру самонагревания твёрдых веществ определяют в термостате, в котором образец материала можно выдерживать при заданной температуре длительное время. За температуру самонагревания принимают минимальную температуру термостата, при которой наблюдается резкое повышение температуры опытного образца, заканчивающееся его возгоранием (воспламенением).
При температуре ниже температуры самонагревания хранение и обработка веществ и материалов не связаны с опасностью их теплового самовозгорания. При температуре выше температуры самонагревания возможность самовозгорания зависит от температуры среды, времени нагрева и массы материала.
Температура самонагревания и время нагрева твердого вещества до самовозгорания (самовоспламенения) определяются по соотношениям:
lg t = A + B*lg S
lg t = C – D*lg t, (2.5)
где t - температура окружающей среды; A, B, C, D - экспериментальные константы; S - удельная поверхность образца; t - время нагревания образца.
Величина S = F/V, где F - поверхность образца, V - его объем. Например, для шара F = 4pR2, V = (4/3)*pR 3, где R - радиус шара; для куба F = 6a2, V=a3, a - ребро куба.
Значение величин А, В, С, Д для некоторых горючих материалов приведены в табл. 6 [6].
Таблица 6
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1957; Нарушение авторских прав?; Мы поможем в написании вашей работы!