
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет реальных и условных констант
Условная константа.
Если посторонние ионы способны вступать с А, В, С или D (см. реакцию 1-1) в конкурирующие реакции с образованием малодиссоциированных или малорастворимых соединений, то состояние равновесия в такой системе следует характеризовать условной константой

Если наряду с реакцией
A + B ↔ C + D
протекают конкурирующие реакции
А + X ↔ АХ
АХ + Х ↔ АХ2 и т. д.
то в растворе кроме А присутствуют АХ, АХ2 и т.д.
Очевидно, что равновесная концентрация любой формы в зависимости от условий составляет ту или иную часть общей концентрации:
[А] = аАCА,[АХ] = аAXСА и т.д.
Коэффициент пропорциональности а называют a -коэффициентом (или молярной долей). Он характеризует глубину протекания конкурирующей реакции, например, между А и посторонним веществом, присутствующим в системе.
Поскольку aA = [A] / CA, то в отсутствие конкурирующей реакции аА = 1, в случае ее протекания аА < 1. Заметим, что иногда удобнее использовать величину 1/ а, называемую коэффициентом конкурирующей реакции. Конкретное выражение а (или 1/ а) зависит от типа конкурирующей реакции (см. примеры).
Запишем соотношение между a A [А] и CA:
для идеальной системы
аА = [А] = CA, так как γА = 1и аА = 1
для реальной системы
аА = γА[А] = γАСА, если γА < 1 и а А = 1
а А = γА[А] = γА а АСА, если γА и а А < 1
Отсюда вытекают соотношения между термодинамической, реальной и условной константами равновесия

Зная К° и умея оценить степень отклонения от идеальности (т.е. имея данные для расчета γ и а), можно рассчитать реальную константу, которая в отличие от К ° зависит не только от р и Т, но и от I, а именно:

или условную константу равновесия, которая зависит от р. Т, I и условий протекания конкурирующих реакций:

ПРИМЕР 3. Термодинамическая константа кислотности азотистой кислоты равна 6.2·10-4. Рассчитайте реальную константу в растворе с ионной силой 0.01.
Решение. В таблицах находим значения коэффициентов активности ионов Н+ и NO2- при ионной силе 0.01:  . Коэффициент активности молекул азотистой кислоты равен единице.
. Коэффициент активности молекул азотистой кислоты равен единице.

Отсюда
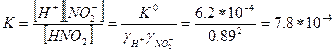
За счет электростатических взаимодействий диссоциация азотистой кислоты усилилась, однако, как показывает следующий пример, электростатические взаимодействия между ионами не могут в заметной степени повлиять на состояние равновесия в системе.
ПРИМЕР 4. Как изменится рН 0.010 М раствора уксусной кислоты, если в него добавить хлорид калия до конечной концентрации 0.020 М?
Решение. Уксусная кислота слабая, поэтому в отсутствие постороннего электролита ионную силу можно принять равной нулю. Это дает право для вычисления рН воспользоваться термодинамической константой кислотности.

Для расчета рН после добавления хлорида калия необходимо вычислить реальную константу кислотности уксусной кислоты

Вычисляем ионную силу, создаваемую ионами калия и хлорида:

При ионной силе 0.02  . Поэтому
. Поэтому
К = 1,75·10-5 / 0,872 = 2,31·10-5
Следовательно,

Итак, увеличение ионной силы от нуля до 0.020 вызвало изменение рН раствора уксусной кислоты всего на 0.06 единиц рН.
Замечание. В некоторых учебниках можно встретить следующие символы: КТ, КР, КУ вместо соответственно К0, К и К', f вместо γ и μ вместо I.
|
|
Дата добавления: 2015-01-03; Просмотров: 4091; Нарушение авторских прав?; Мы поможем в написании вашей работы!