
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оборудование и реактивы. Определение общей жесткости
|
|
|
|
Определение общей жесткости
Баня водяная; ножницы; палочка стеклянная; пипетка на 2 мл или на
5 мл с резиновой грушей (медицинским шприцем) и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Вода дистиллированная; раствор буферный аммиачный; раствор индикатора хром темно-синего кислотного; раствор трилона Б (0,05 г-экв/л).
О приготовлении растворов см. приложение 3.
Выполнение анализа
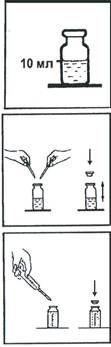 1.В склянку налейте 10 мл анализируемой воды.
1.В склянку налейте 10 мл анализируемой воды.
2. Добавьте в склянку пипетками 6-7 капель раствора буферного аммиачного и 4-5 капель раствора индикатора хрома темно-синего кислотного.
3. Герметично закройте склянку пробкой и встряхните для перемешивания.
4. Постепенно титруйте содержимое склянки раствором трилона Б до перехода окраски в точке эквивалентности из винно-красной в ярко-голубую. Периодически встряхивайте склянку для перемешивания пробы. Определите объем раствора, израсходованный на титрование общей жесткости (Vож, мл).
5. Рассчитайте величину общей жесткости (Сож) в мг-экв/л по формуле: Cож = Vож × 5.
Примечание. После изменения окраски пробу необходимо выдержать еще 0,5 мин. для полного протекания реакции, после чего принять решение об окончании титрования (окраска раствора может несколько восстановиться. В этом случае необходимо добавить еще некоторое количество раствора трилона Б).
Кальций. Главными источниками поступления кальция в поверхностные воды являются процессы химического выветривания и растворения минералов, прежде всего известняков, доломитов, гипса, кальцийсодержащих силикатов и других осадочных и метаморфических
пород.
CaCO3 + CO2 + H2O Û Са(HCO3)2 Û Ca2+ + 2HCO3-
Растворению способствуют микробиологические процессы разложения органических веществ, сопровождающиеся понижением рН.
|
|
|
Большие количества кальция выносятся со сточными водами силикатной, металлургической, стекольной, химической промышленности и со стоками с сельскохозяйственных угодий, особенно при использовании кальцийсодержащих минеральных удобрений.
Характерной особенностью кальция является склонность образовывать в поверхностных водах довольно устойчивые пересыщенные растворы CaCO3. Ионная форма (Ca2+) характерна только для маломинерализованных природных вод. Известны довольно устойчивые комплексные соединения кальция с органическими веществами, содержащимися в воде. В некоторых маломинерализованных окрашенных водах до
90-100 % ионов кальция могут быть связаны гумусовыми кислотами.
В речных водах содержание кальция редко превышает 1 г/дм3. Обычно же его концентрации значительно ниже.
Концентрация кальция в поверхностных водах подвержена заметным сезонным колебаниям. В период понижения минерализации (весной) ионам кальция принадлежит преобладающая роль, что связано с легкостью выщелачивания растворимых солей кальция из поверхностного слоя почв и пород.
ПДКвр кальция составляет 180 мг/дм3.
Довольно жесткие требования по содержанию кальция предъявляются к водам, питающим паросиловые установки, поскольку в присутствии карбонатов, сульфатов и ряда других анионов кальций образует прочную накипь. Данные о содержании кальция в водах необходимы также при решении вопросов, связанных с формированием химического состава природных вод, их происхождением, а также при исследовании карбонатно-кальциевого равновесия.
Метод определениямассовой концентрации катиона кальция (ГОСТ 1030) аналогичен методу определения общей жесткости с реактивом трилоном Б с той разницей, что анализ проводится в сильнощелочной среде (рН 12-13) в присутствии индикатора мурексида.
Массовую концентрацию кальция рассчитывают по результатам титрования по такой же формуле.Определению кальция мешают карбонаты и диоксид углерода, удаляемые из пробы при ее подкислении.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 629; Нарушение авторских прав?; Мы поможем в написании вашей работы!