
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Участие аминокислот в процессах катаболизма
Одним из путей катаболизма (деградации) аминокислот является их ферментативное декарбоксилирование (см.), приводящее к освобождению углекислого газа и образованию биогенных аминов, обладающих высокой биологической активностью, напр, гистамина
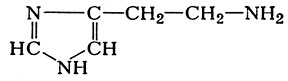
из гистидина; серотонина
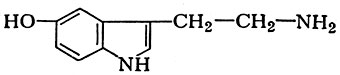
из окситриптофана; γ-аминомасляной к-ты из глутаминовой к-ты:
H2N-CH2-CH2-CH2-COOH
тирамина из тирозина
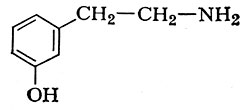
Декарбоксилирование аминокислот катализируется декарбоксилазами (см.), коферментом к-рых обычно является пиридоксальфосфат, однако механизм декарбоксилирования аминокислот остается недостаточно выясненным. В декарбоксилазе гистидина коферментная функция принадлежит остатку пировиноградной к-ты, карбоксильная группа к-рой соединена с пептидной цепью белка-фермента кислотноамидной связью:
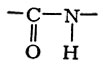
Образовавшиеся при декарбоксилировании аминокислот амины служат субстратами окисления для моноамино- и диаминооксидаз — ферментов, отличающихся друг от друга не только белковой частью, но и коферментами: митохондриалыше моноаминооксидазы (см.) принадлежат к флавопротеидам, их кофсрмент — флавинадениндинуклеотид. У диаминооксидаз коферментом служит пиридоксальфосфат. Образующиеся при дезаминированип монаминов аммиак и альдегиды претерпевают дальнейшие превращения: обезвреживание аммиака происходит преимущественно путем образования мочевины (см.), углеродный скелет аминов (в виде альдегидов) подвергается дальнейшему окислению.
Другим процессом деградации L-аминокислот является их окислительное дезаминирование (см.), идущее с образованием аммиака и кетокислот. Эта реакция протекает в организме высших животных и человека очень медленно (в противоположность окислительному образованию аммиака из D-аминокислот), однако может осуществляться быстрее косвенным путем: сначала при персаминировании образуется α-глутаминовая к-та, к-рая затем при дезаминировании является источником кетоглутаровой к-ты и аммиака. Следует, однако, учесть, что в реакции дезаминирования равновесие смещено в сторону восстановительного образования глутаминовой к-ты, т. е. слева направо:

Пути образования аммиака из аминокислот остаются недостаточно ясными.
В последнее время Г. X. Бунатяном и его сотрудниками большое значение в процессе образования аммиака (в частности, в ц. н. с. и в печени) приписывается отщеплению NH2-группы аденина, находящегося в составе никотинамидадениндпнуклеотида (НАД). Продуктом этой реакции является дезамгшоникотинамид-адениндинуклеотид (деНАД):
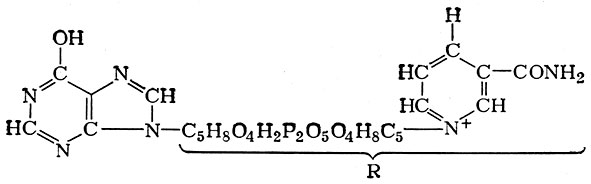
Дезаминоникотинамидадениндинуклеотид (деНАД)
Последующее аминирование деНАД осуществляется при участии аспа-рагиновой к-ты, протекает с образованием промежуточного продукта (НАД-янтарной к-ты) и после отщепления фумаровой к-ты приводит к восстановлению первоначальной структуры НАД (рис. 4):
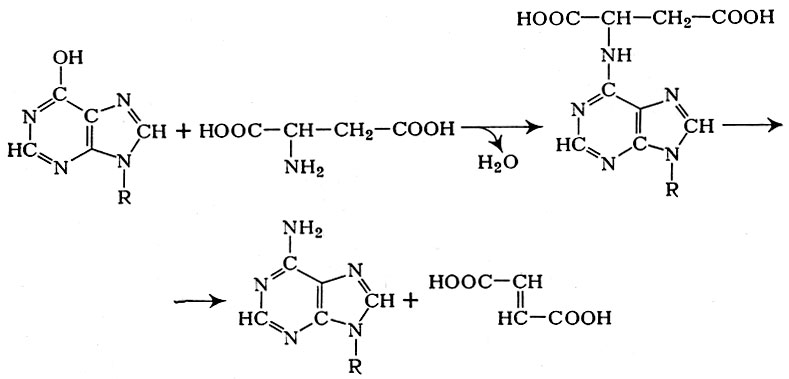
Рис. 4. Схема превращении дезамнноникотинамидадениндннуклеотида
Следовательно, по Г. X. Бунатяну, дезаминирование α-аминокислот с образованием аммиака протекает через образование аспарагиновой к-ты путем переаминирования, передачи аминогруппы на деНАД, образования НАД и отщепления аммиака от НАД.
В наст. время еще невозможно оценить, насколько широко этот процесс представлен в организме и каково его биологическое значение. ДеНАД приписывают высокую биологическую активность в качестве фактора, легко проникающего как в окисленной, так и в восстановленной форме через мембрану митохондрий и значительно повышающего энергетическую эффективность окислительного фосфорилирования.
|
|
Дата добавления: 2015-05-06; Просмотров: 506; Нарушение авторских прав?; Мы поможем в написании вашей работы!