
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Устойчивость комплексных ионов Диссоциация комплексных соединений в растворе. Константа нестойкости
Характер химической связи в комплексных соединениях. Электростатическое и донорно-акцепторное взаимодействие. Факторы, определяющие способность иона быть комплексообразователем. Типичные лиганды.
Водородные соединения. Зависимость строения и свойств водородных соединений от положения элемента в периодической системе. Особенности строения и химических свойств солеподобных гидридов s- элементов. Строение молекул и химические свойства ковалентных гидридов р- элементов.
Простые вещества. Молекулярное и немолекулярное строение простых веществ. Металлические и неметаллические свойства в зависимости от положения элемента в периодической системе, граница между металлами и неметаллами.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул), в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
Молекулярные и немолекулярные вещества — один из признаков химических веществ относительно их строения.
Молекулярные вещества — это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы — наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства. Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Ион — это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Металлические и неметаллические свойства в зависимости от положения элемента в периодической системе, граница между металлами и неметаллами.
Металлы ― это элементы, атомы которых отдают свои внешние электроны.
Неметаллы ― это элементы, атомы которых стремятся принять на внешний энергетический уровень электроны, недостающие до восьми.
1. При перемещении СПРАВА НАЛЕВО вдоль ПЕРИОДА МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении - возрастают неметаллические. Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях. Например, углерод - более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод. Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!), все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того - в левой или правой части таблицы они находятся. У d- и f-элементов, как мы знаем, есть "резервные" электроны из "предпоследних" оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства. Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы.
Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам. Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный "блок" (это сделано в “длинной” форме таблицы), то обнаружится закономерность. Левая нижняя часть блока содержит типичные металлы, правая верхняя - типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной "октетной" ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них - существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее. Граница между металлами и неметаллами в периодической таблице (в ее длинном варианте) проводится по диагонали от В до At.
С металлами водород образует (за некоторорым исключение) летучие соединения, которые являются твердыми веществами немолекулярного строенияю поэтому их температуры плавления сравнительно высоки. Эти вещества подвергаются полному гидролизу:
NaH+H2O=NaOH+H2
NaH=Na++H-
H-+H++OH=H2+OH-
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
Проследим как изменяются свойства летучих водородных соединений неметаллов в периодах слева направо. Так, например, рассмотрим водородные соединений элементов 2-го периода – азота и фтора. Аммиак NH 3 обладает основными свойствами, а фтороводород кислотными. Такими же свойствами обладают водородные соединения 3-го периода – фосфин PH 3 и хлороводород.
В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливаются.
С очень активными металалми водород взаимодействует непосредственно как окислитель, превращаясь в анион, называемый гидрид-анионом. Эти кристаллические вещества относятся к классу солей и при действии воды полностью разлагаются с выделением водорода и образованием щелочи.
Практически все элементы образуют с водородом соединения, которые можно разделить на 3 основные группы: ковалентные, ионные и металлические.
Атомы всех элементов с IVA по VIIA группу устанавливают с атомами водорода ковалентные связи, что приводит к образованию отдельных молекул, и поэтому соединения водорода с элементами этих групп являются летучими веществами с низкими температурами кипения. Атомы металлов IA и IIA групп (за исключением бериллия и магния), являясь сильными восстановителями, устанавливают ионные связи с атомами водорода, восстанавливая их в ионы H-, в результате чего образуются ионные кристаллы, и внешне и по структуре сходные с солями. Такие солеобразные соединения водорода называются гидридами.
Наиболее обширную группу соединений с водородом образуют d-элементы, т.е. элементы всех B-групп. Эти соединения называются металлическими гидридами. По внешнему виду и по структуре они мало отличаются от порошков соответствующих металлов, обладают электрической проводимостью и теплопроводностью. Гибриды d-металлов имеют переменный состав и этим напоминают сплавы.
Выводы:
1. В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
2. В группах сверху вниз отрицаительно заряженные анионы все слабее притягивают положительно заряженные ионы водорода. В связи с этим облегчается процесс отщепления ионов водорода и кислотные свойства водородных соединений увеличиваются.
3. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами реагируют со щелочами. Водородные же соединения, обладающие в водных растворах основными свойствами реагируют с кислотами.
4. Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путем нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
Комплексные соединения или координационные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Химическая связь в комплексных соединениях.
Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
1. Связь между комплексообразователем и лигандами донорно-акцепторная σ-типа. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали.
2.Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации, которая определяет геометрию комплекса. Тип гибридизации определяется числом, природой и электронной структурой лигандов.
3.Дополнительное упрочение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбитальюлиганда.
4.Магнитные свойства комплекса объясняются исходя из заселённости орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
Электростатическое межмолекулярное взаимодействие
Оно же "силы Ван-дер-Ваальса". Делится на ориентационное, индукционное и дисперсионное.
Ориентационные силы, диполь-дипольное притяжение: Осуществляется между молекулами, являющимися постоянными диполями. В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействие между мгновенным и наведенным диполем. При сближении молекул ориентация микродиполей перестает быть независимой и их появление и исчезновение в разных молекулах происходит в такт друг другу. Синхронное появление и исчезновение микродиполей разных молекул сопровождается их притяжением. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Встречаются полярная и неполярная молекулы. Под действием полярной молекулы неполярная молекула деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы и в свою очередь усиливает электрический момент диполя полярной молекулы. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Относительный вклад каждого из видов межмолекулярных сил зависит в основном от двух свойств взаимодействующих молекул: полярности и поляризуемости (деформируемости). Чем выше полярность, тем значительнее роль ориентационных сил: чем больше деформируемость, тем значительнее роль дисперсионных сил. Индукционные силы зависят от обоих факторов, но сами обычно играют второстепенную роль. Вандерваальсовы силы обуславливают агрегатное состояние вещества. По сравнению с ковалентной связью вандерваальсово взаимодействие очень слабое.
Донорно-акцепторное межмолекулярное взаимодействие
Возникает за счет электронной пары одной молекулы и свободной орбитали другой. Это взаимодействие проявляется в первичных актах многих химических реакций, лежит в основе каталитических процессов, обусловливает сольватацию молекул и ионов в растворах, может приводить к образованию новых соединений. За счет данного типа взаимодействия может образоваться межмолекулярный комплекс. Оно также часто вызывает переход вещества из газового в жидкое и твердое агрегатное состояния.
Лиганды – атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
Комплексные ионы способны диссоциировать на образующие их частицы: уосплексообразователь и лиганды. Этот процесс обратим. В результате в растворах комплексных электролитов устанавливается равновесие между комплексными ионами и образующими их частицами. Например:
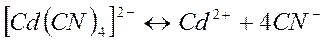
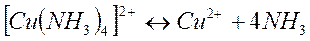
Константа этого равновесия называется константой нестойкости. Ею характеризуется степень устойчивости уосплекса. Чем меньше константа нестойкости, тем прочнее комплекс. Например:
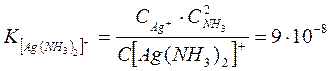
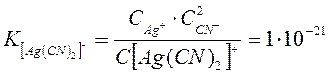
Эти константы показывают, что комплексный ион  во много раз прочнее второго комплексного иона.
во много раз прочнее второго комплексного иона.
При большом значении константы нестойкости комплексный ион в водном растворе почти послностью распадается на образующие его комплекснообразователь и лиганды. С этой точки зрения можно рассматривать двойные соли как комплексные соединения очень малой стойкости.
Устойчивость комплексных соединений. Константа нестойкости: В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно. Например, диссоциация комплексной соли [Ag(NH3)2]Cl протекает по следующим стадиям:
Первая стадия: [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-
Вторая стадия:1. Ag(NH3)2]+ AgNH3+ + NH3
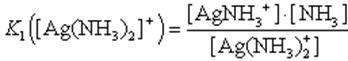
2. AgNH3+ Ag+ + NH3
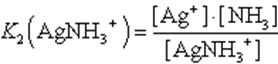
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере
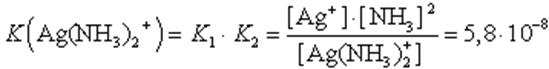 (9.1)
(9.1)
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости:
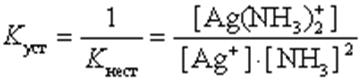 (9.2)
(9.2)
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости. Так, среди соединений
[Ag(NO2)2]- [Ag(NH3)2]+ [Ag(S2O3)]- [Ag(CN)2]-
K нест 1,3 · 10-3 5,8 · 10 -8 1,5 · 10 -9 1,4 · 10-20
устойчивость комплекса возрастает при переходе от [Ag(NO2)2] - к [Ag(CN)2] -.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2] + Kнест = 5,8 · 10 -8, а для иона [Ag(CN)2] - Kнест = 1,4 · 10 -20, поэтому при действии раствора КСN аммиакат серебра разрушается с образованием иона [Ag(CN)2] -:
[Ag(NH3)2]Cl = 2KCN = K[Ag(CN)2] + 2NH3 = KCl
Зная константы нестойкости различных комплексов, можно теоретически вычислить концентрацию соответствующих простых ионов в растворах комплексных солей.
|
|
Дата добавления: 2015-04-24; Просмотров: 3438; Нарушение авторских прав?; Мы поможем в написании вашей работы!