
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет 25. Константа диссоциацииэлектролитов. Закон разбавления Оствальда. Особенность диссоциации слабых многоосновных кислот
|
|
|
|
Билет 24. Степень электролитической диссоциации и её зависимость от различных факторов. Деление электролитов на сильные, средние и слабые.
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. При этом возможны диссоциативный и ионизационный механизмы. Диссоциативный механизм превалирует при разрушении ионной кристаллической решетки под воздействием сольватирующего растворителя. Для количественной оценки процесса диссоциации введено понятие степени электролитической диссоциации (α)– это число, показывающее, какая часть молекул электролита находится в растворе в виде ионов: 
Степень электролитической диссоциации изменяется от до 1, и может быть выражена в долях единицы или процентах. По величине степени диссоциации электролиты можно разделить на сильные, средние и слабые. Для сильных электролитов α≥30%. К ним относят все растворимые соли, некоторые минеральные кислоты HCl,HNO3, H2SO4, HClO4 и др., а также гидроксиды щелочных и щелочноземельных металлов. Средние электролиты имеют α в пределах от 3 до 30%. Это такие соединения, как H2SO4, H3PO4, и т. д. Слабые электролиты (α<3%): H2S,HNO3,H2CO3,CH3COOH,H2SiO3 и др., большинство оснований, практически все органические кислоты и вода.
Константа диссоциации показывает отношение произведения концентраций ионов в растворе слабого электролита к концентрации недиссоциированных молекул. Следует одчеркнуть, что для сильных электролитов в разбавленных растворах не существует недиссоциированных молекул. Следовательно, для них понятие константы диссоциации не имеет смысла. Таким образом, константа диссоциации может служить критерием деления электролитов на сильные и слабые. Слабые электролиты характеризуются константой диссоциации, а у сильных электролитов она отсутствует. Константа диссоциации слабых электролитов является мерой их относительной силы: чем она больше, тем значительнее при прочих равных условиях электролит диссоциирует на ионы, т.е. тем он сильнее. Степень диссоциации, константа диссоциации и концентрация раствора связаны между собой.
|
|
|
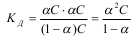 Это уравнение является математическим выражением закона
Это уравнение является математическим выражением закона
разбавления Оствальда. Для очень слабых электролитов при α<<1 уравнение прощается, так как величиной α можно пренебречь, т.е. 1-α->1: 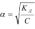 .Можно сделать вывод: с уменьшением концентрации электролита в растворе степень его электролитической диссоциации возрастает. Слабые многоосновные кислоты и основания при растворении в воде диссоциируют на ионы ступенчато, последовательно отдавая в раствор один, два и более ионов водорода или гидроксильных групп. Естественно, что для каждой ступени равновесного состояния существует своя константа диссоциации.
.Можно сделать вывод: с уменьшением концентрации электролита в растворе степень его электролитической диссоциации возрастает. Слабые многоосновные кислоты и основания при растворении в воде диссоциируют на ионы ступенчато, последовательно отдавая в раствор один, два и более ионов водорода или гидроксильных групп. Естественно, что для каждой ступени равновесного состояния существует своя константа диссоциации.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1189; Нарушение авторских прав?; Мы поможем в написании вашей работы!