
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение. Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам
|
|
|
|
Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом.
Комплексные соединения находят широкое применение в различных отраслях промышленности. Химические методы извлечения металлов из руд связаны с образованием КС. Например, для отделения золота от породы руду обрабатывают раствором цианида натрия в присутствии кислорода. Метод извлечения золота из руд с помощью растворов цианидов был предложен в 1843 г. русским инженером П. Багратионом. Для получения чистых железа, никеля, кобальта используют термическое разложение карбонилов металлов. Эти соединения — летучие жидкости, легко разлагающиеся с выделением соответствующих металлов.
Широкое применение комплексные соединения получили в аналитической химии в качестве индикаторов.
Многие КС обладают каталитической активностью, поэтому их широко используют в неорганическом и органическом синтезах. Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических продуктов: лаков, красок, металлов, фотоматериалов, катализаторов, надёжных средств для переработки и консервирования пищи и т. д.
Комплесные соединения цианидов имеют важное значение в гальванопластике, так как из обычной соли бывает невозможно получить настолько прочное покрытие как при использовании комплексов.
Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов:
|
|
|
[ML] M + L; K1(нест) = [M] ´ [L] / [ML]
[ML2] [ML] + L; K2(нест) = [ML] ´ [L] / [ML2]
…….
[MLn] [ML(n-1)] + L; Kn(нест) = [ML(n-1)] ´ [L] / [MLn];
и общих (суммарных) констант нестойкости комплексов:
[ML] M + L; b1(нест) = [M] ´ [L] / [ML]
[ML2] M + 2 L; b2(нест) = [M] ´ [L]2 / [ML2]
[ML3] M + 3 L; b3(нест) = [M] ´ [L]3 / [ML3]
…….
[MLn] M + n L; bn(нест) = [M] ´ [L]n / [MLn]
Ступенчатые и общие константы образования и нестойкости комплексов соотносятся друг с другом как обратные величины:
bn(обр) = 1 / b n(нест); Kn(обр) = 1 / Kn(нест),
поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости.
Ступенчатое комплексообразование можно проиллюстрировать примером взаимодействия иона Hg2+ (как комплексообразователя) с ионами Cl- (как лигандом):
Hg2+ + Cl- [HgCl]+; K1(обр) = 1,85. 105
[HgCl]+ + Cl- [HgCl2]; K2(обр) = 3,2. 107
[HgCl2] + Cl- [HgCl3]-; K3(обр) = 14
[HgCl3]- + Cl- [HgCl4]2-; K4(обр) = 10
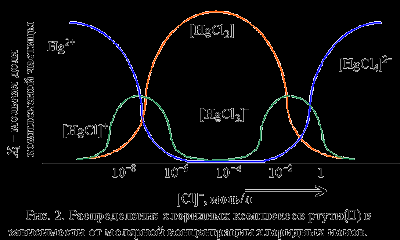
Чем больше концентрация хлоридных ионов, тем с большим координационным числом образуется комплексное соединение. Как только будет достигнуто максимально возможное для данного комплексообразователя координационное число, образование новых комплексных соединений приостанавливается, и при дальнейшем увеличении концентрации лиганда наблюдается постепенное исчезновение в растворе комплексных частиц с меньшими координационными числами.
Из рис. 2 видно, что уже при концентрации хлорид-ионов, равной 1. 10-5 моль/л, в растворе полностью исчезают катионы Hg2+ и образуются преимущественно нейтральные частицы [HgCl2]. При концентрации хлорид-ионов около 0,1 моль/л в растворе присутствуют комплексы [HgCl2], [HgCl3]- и [HgCl4]2-.
При концентрации ионов Cl- свыше 1 моль/л в растворе присутствуют только тетрахлоромеркурат(II)-ионы [HgCl4]2-, которые довольно легко диссоциируют, отщепляя хлоридный лиганд, но обладают достаточно высокой полной константой образования:
|
|
|
b4(обр) = K1(обр) ´ K2(обр) ´ K3(обр) ´ K4(обр) =
= (1,85. 105) ´ (3,2. 107) ´14 ´10 = 8,3. 1014
Таким образом, полная константа образования дает возможность судить об отсутствии склонности комплекса к полной диссоциации, а ступенчатая константа образования свидетельствует об устойчивости отдельных форм комплексных ионов или нейтральных комплексов.
Как правило, ступенчатые константы образования уменьшаются по мере возрастания числа лигандов. Например, взаимодействие такого комплексообразователя, как ион Cd2+, с молекулами аммиака, выполняющими функции лиганда, протекает поэтапно, с постепенным уменьшением значения ступенчатой константы образования:
Cd2+ + NH3 [Cd(NH3)]2+; K1(обр) = 450
[Cd(NH3)]2+ + NH3 [Cd(NH3)2]2+; K2(обр) = 126
[Cd(NH3)2]2+ + NH3 [Cd(NH3)3]2+; K3(обр) = 27,5
[Cd(NH3)3]2+ + NH3 [Cd(NH3)4]2+; K4(обр) = 8,5
[Cd(NH3)4]2+ + NH3 [Cd(NH3)5]2+; K5(обр) = 0,47
[Cd(NH3)5]2+ + NH3 [Cd(NH3)6]2+; K6(обр) = 0,02
Однако бывают и исключения, например, уже указанные выше хлоридные комплексы ртути(II).
Среди причин закономерного уменьшения значений ступенчатых констант образования с увеличением числа лигандов прежде всего выделяют возрастание пространственных затруднений в размещении вокруг комплексообразователя все большего числа лигандов и электростатическое отталкивание одноименно заряженных лигандов.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 573; Нарушение авторских прав?; Мы поможем в написании вашей работы!