
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Властивості розчинів неелектролітів
Розчинені речовини поділяють на неелектроліти та електроліти. Неелектроліти розподіляються у масі розчинника у вигляді молекул, тобто не дисоціюють на йони. Тому розчини неелектролітів не проводять електричний струм. До неелектролітів належать у більшості органічні сполуки, наприклад, глюкоза, сахароза, крохмаль, карбамід, анілін тощо.
З різних властивостей розчинів неелектролітів розглянемо в першу чергу тиск насиченої пари розчинника над розчином, тому шо з його величиною пов'язані і інші властивості розчинів, такі, як температура кипіння та температура замерзання розчинів.
На малюнку зображені дві посудини: одна з рідким чистим розчинником, а інша - з розбавленим розчином нелеткого неелектроліту. Молекули розчинника позначимо "х", а молекули розчиненої речовини - "о". Оскільки розчинена речовина практично не випаровується, то пара над розчином складається тільки з молекул розчинника.

Між рідиною та парою встановлюється рівновага: швидкість випаровування рідини дорівнює швидкості конденсації пари у рідину, тобто число молекул, що залишають поверхню рідини за одиницю часу, дорівнює числу молекул, що повертаються до рідини. Пара, що знаходиться у рівновазі з рідиною, називається насиченою. З розчинів випаровування відбувається не з усієї поверхні рідини, а тільки з тієї її частини, яка зайнята молекулами розчинника. Крім того, кількість молекул розчинника, що випаровується, зменшується внаслідок зв'язування з молекулами розчиненої речовини з утворенням сольватів. Тому за сталої температури тиск насиченої пари розчинника над розчином p менший, ніж тиск насиченої пари розчинника над чистим розчинником p°, тобто p < p°.
Різниця між цими величинами (p° – p), тобто зниження тиску насиченої пари розчинника над розчином (Δp), тим більша, чим вища концентрація розчиненої речовини у розчині, але не залежить від її природи.
Перший закон Payля: “Відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини у розчині.”
Математичний вираз першого закону Рауля:
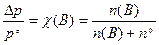 , (8.1)
, (8.1)
де Δ p=p° – p, а концентрація замінена на молярну частку розчиненої речовини χ(B); n(B) - кiлькiсть розчиненої речовини, n0 - кількість розчинника.
Тиск насиченої пари залежить від температури: за нагрівання тиск насиченої пари збільшується. На малюнку наведена залежність від температури тиску насиченої пари розчинника над рідким чистим розчинником – ОА, над розчином – О'Е, над твердим розчинником – ВО.
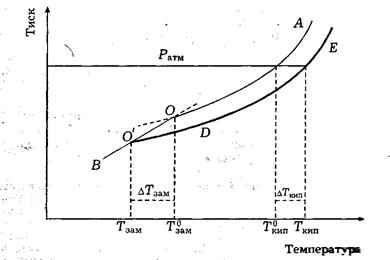
Оскільки тиск насиченої пари розчинника над розчином менший, ніж над чистим розчинником, то крива О`Е розташована нижче, ніж ОА.
Будь-яка рідина закипає тоді, коли тиск насиченої пари досягає величини зовнішнього тиску. Тому температуру кипіння розчинника та розчину знаходять, опускаючи вертикальну лінію з точки перетину кривих ОА та О`Е з прямою, яка відтинає на осі ординат зовнішній тиск. Як видно з малюнку, температура кипіння розчину Ткип. вища за температуру кипіння розчинника Т0кип., оскільки за температури Т0кип. тиск насиченої пари розчинника над розчином нижчий за зовнішній тиск. Підвищення температури кипіння розчину – це різниця між температурою кипіння розчину та температурою кипіння розчинника:
DТкип. = Ткип. – Т0кип.
За зниження температури починається кристалізація розбавлених розчинів. При цьому утворюються тільки кристали розчинника. Між рідиною та кристалами встановлюється рівновага. У стані рівноваги тиск насиченої пари розчинника над рідиною дорівнює тиску насиченої пари розчинника над кристалами. Тому температури замерзання (кристалізації) розчинника та розчину відповідають точкам перетину кривої ВО з кривими ОА та О`Е, тобто точкам О та О`. Як видно з малюнку, температура замерзання розчину Тзам. нижча за температуру замерзання розчинника Т0зам., оскільки за температури Т0зам. тиск насиченої пари розчинника над розчином менший за тиск насиченої пари розчинника над кристалами. Зниження температури замерзання розчину – це різниця між температурою замерзання розчинника та температурою замерзання розчину:
DТзам. = Т0зам. – Тзам.
Чим більша концентрація розчиненоі речовини у розчині, незалежно від її природи, тим більші підвищення температури кипіння та зниження температури замерзання розчину.
Оскільки з розчинів нелеткого неелектроліту під час кипіння випаровується або під час замерзання кристалізується лише розчинник, то концентрація розчиненої речовини з часом збільшується. Це призводить до ще більшого підвищення температури кипіння та ще нижчої температури замерзання розчинів. Отже, розчин на відміну від розчинника кипить та замерзає не за сталої температури, а у деякому температурному інтервалі. Початок температурного інтервала називають відповідно температурою кипіння або температурою замерзання (кристалізації) розчинів.
Другий закон Рауля: “Підвищення температури кипіння розчину та зниження температури замерзання розчину прямо пропорційні моляльності розчиненої речовини у розчині.”
Математичний вираз другого закону Рауля:
ΔТкип.= E сm(B), (8.2)
ΔТзам.= K сm(B), (8.3)
де Е та К - відповідно ебуліоскопічний та кріоскопічний коефіцієнти, а концентрація замінена на моляльність розчиненої речовини сm(B). Як зазначалось (7.6), моляльність розчиненої речовини - це вiдношення кількості розчиненоі речовини n(B) до маси розчинника mр-ка:
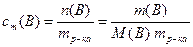 моль/(кг розчинника),
моль/(кг розчинника),
Отже:
 , (8.4)
, (8.4)
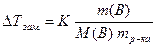 . (8.5)
. (8.5)
З виразів (8.2) та (8.3) випливає:
E= 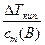 , K=
, K= 
Отже, коефіцієнти Е та К вимірюються у К·кг·моль-1.
Фізичний зміст ебуліоскопічного та кріоскопічного коефіцієнтів. Якщо сm(B) = 1 моль/(кг розчинника), то ебуліоскопічний коефіцієнт чисельно дорівнює підвищенню температури кипіння розчину порівняно з температурою кипіння розчинника, а кріоскопічний коефіцієнт -зниженню температури замерзання розчину порівняно з температурою замерзання розчинника:
Е = DТкип., (8.6)
K = DТзам.. (8.7)
Значення ебуліоскопічного та кріоскопічного коефіцієнтів не залежать від природи та концентрації розчиненої речовини, а залежать лише від природи розчинника. Отже, ебуліоскопічний та кріоскопічний коефіцієнти є характерними величинами для певного розчинника. Так, ебуліоскопічний коефіцієнт води дорівнює: Е(Н2O) = 0,52 К·кг·моль-1, бензолу – Е(С6Н6) = 2,6 К·кг·моль-1, ефіру – Ееф = 2,02 К·кг·моль-1. Кріоскопічний коефіцієнт води дорівнює: К(H2O) = 1,86 К·кг·моль-1, бензолу – К(С6Н6) = 5,1 К·кг·моль-1, ефіру – Кеф=1,73 К·кг·моль-1.
Вимірявши DТкип. або DТзам. розчину, за виразами (8.4) та (8.5) можна обчислити молярну масу розчиненого нелеткого неелектроліту. Практичне визначення молярних мас розчинених речовин за зниженням температури замерзання розчинів називають кріоскопією, а за підвищенням температури кипіння розчинів – ебуліоскопією.
Оскільки підвищення температури кипіння та зниження температури замерзання розчинів залежать лише від моляльності розчиненої речовини, а не від її природи, то згідно з третім законом Рауля:
“Розчини різних неелектролітів з однаковою моляльністю розчиненої речовини киплять за однакової температури та замерзають за однакової температури.”
Приклад 1. За температури 250С тиск насиченої водяної пари р0 становить 3,166 кПа. Розрахуйте за цих же умов тиск насиченої водяної пари над розчином, який містить у воді масою 720 г глюкозу С6Н12О6 масою 45 г.
Розв'язання. Розрахуємо:
а) кількість глюкози та кількість води у розчині (1.7):


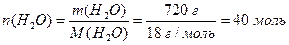 .
.
б) молярну частку глюкози (7.5):
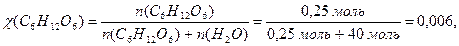
в) зниження тиску насиченої водяної пари над розчином (8.1):
Δ р = р0 · χ(С6Н12О6) = 3,166 кПа · 0,006 = 0,019 кПа,
г) тиск насиченої водяної пари над розчином:
Δ р = р0 – р; р = р0 – Δ р = 3,166кПа – 0,019 кПа = 3,147 кПа.
Приклад 2. Розрахуйте температуру замерзання водного розчину з масовою часткою гліцерину ω(С3Н8О3)=4,6% (0,046 в частках від одиниці).
Розв'язання.
а) Розрахуємо моляльність гліцерину у водному розчині (7.6):
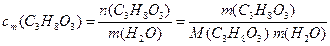
Підставляємо у цей вираз значення маси гліцерину у грамах та масу розчинника (Н2О) у кілограмах, виходячи із співвідношення (7.1):
m(C3H8O3)=ω(C3H8O3) mр=0,046 mр,
m(H2O)=ω(H2O) mр= (1– ω(C3H8O3)) mр=0,954 mр·10–3,
де mр – маса розчину.
Отже:
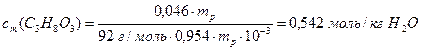
б) Обчислюємо згідно з другим законом Рауля зниження температури замерзання розчину (8.3):
ΔТзам.= K(Н2О) сm(С3Н8О3) = 1,86 К·кг/моль · 0,542 моль/кг = 0,974 К.
Враховуючи, що зниження температури замерзання та підвищення температури кипіння розчину не залежать від того, за якою шкалою: Кельвіна чи Цельсія – їх розглядають, то Δtзам. = ΔТзам., а Δtкип. = ΔТкип.. Тобто у цьому прикладі Δtзам. = 0,974 0С, а температура замерзання розчину дорівнює:
tзам. розчину = tзам.(Н2О) – Δtзам. = 0 – 0,974 = -0,974 0С.
Приклад 3. Розчин, що містить ефір (розчинник) масою 100 г та розчинену речовину масою 8 г, кипить за температури 36,86 0С. Температура кипіння чистого ефіру становить 35,60 0С. Розрахуйте молекулярну масу розчиненої речовини.
Розв'язання. За умовою прикладу знаходимо підвищення температури кипіння розчину порівняно з температурою кипіння розчинника:
Δtкип. = tкип. розчину – tкип. ефіру = 36,86 – 35,60 = 1,26 0С.
Обчислимо молярну масу розчиненої речовини, користуючись математичним виразом другого закону Рауля (8.2) та (8.4), і враховуючи, що ебуліоскопічний коефіцієнт ефіру становить 2,02 К·кг·моль-1, а ΔТкип.=Δtкип.:
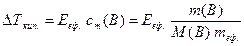 .
.
Звідки:
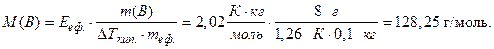
Молекулярна маса речовини – величина безрозмірна і чисельно дорівнює молярній масі: Mr (B) = 128,25.
Приклад 4. Моляльність глюкози в одному водному розчині та моляльнісь сахарози в іншому водному розчині дорівнюють 1 моль/кг(Н2О). Розрахуйте температуру кипіння та температуру замерзання цих розчинів.
Розв'язання.
Згідно з другим законом Рауля (8.2), (8.3):
ΔТкип.= E(Н2О) сm(B),
ΔТзам.= K(Н2О) сm(B).
Моляльність розчиненої речовини в обох розчинах однакова і дорівнює:
сm(B) = 1 моль/кг(H2O), а E(Н2О) = 0,52 K∙кг·моль-1, K(Н2О) = 1,86 K∙кг·моль-1.
Тому: ΔТкип. = 0,52 K∙кг/моль ∙ 1 моль/кг = 0,52 К,
ΔТзам. = 1,86 K∙кг/моль ∙ 1 моль/кг = 1,86 K
Оскільки Δtкип. = ΔТкип., а Δ.t зам. = ΔТзам., то:
tкип. розчинів = tкип. води + Δtкип. = 100 + 0,52 = 100,52 0С
tзам. розчинів = tзам. води – Δtзам. = 0 – 1,86 = -1,86 0С.
|
|
Дата добавления: 2015-05-23; Просмотров: 1979; Нарушение авторских прав?; Мы поможем в написании вашей работы!