
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Швидкість реакції зросла у
|
|
|
|
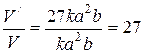 разів.
разів.
Приклад 3. Визначити в скільки разів збільшиться швидкість реакції з підвищенням температури на 400С, якщо температурний коефіцієнт реакції дорівнює 3.
Розв’язання. Для вирішення задачі користуємося правилом Вант-Гоффа:
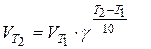 або
або 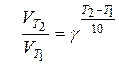
За умовою задачі температура зросла на 400С, тобто 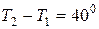 . Отже
. Отже
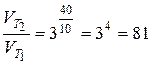 .
.
Таким чином, швидкість реакції зросла у 81 раз.
Приклад 4. При 353 К реакція закінчується за 20 с. Скільки часу потрібно для даної реакції при температурі 293 К, якщо температурний коефіцієнт реакції дорівнює 2,5?
Розв’язання. Між швидкістю хімічної реакції та часом, за який вона відбувається, існує обернено пропорційна залежність:
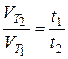 ,
,
де 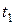 і
і 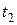 - час перебігу реакції при температурах
- час перебігу реакції при температурах  і
і 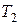 .
.
Правило Вант-Гоффа в даному випадку можна записати так:
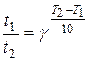 або
або 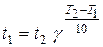
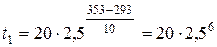
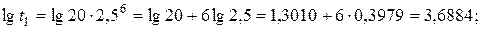
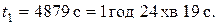
При температурі 293 К дана реакція закінчується за 1 год 24 хв 19 с.
Приклад 5. Знайти температурний коефіцієнт швидкості розкладу мурашиної кислоти на  і
і  в присутності золотого каталізатора, якщо константа швидкості даної реакції при 413 К дорівнює
в присутності золотого каталізатора, якщо константа швидкості даної реакції при 413 К дорівнює 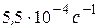 , а при 458 К –
, а при 458 К – 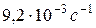 .
.
Розв’язання. Температурний коефіцієнт визначаємо, користуючись правилом Вант-Гоффа:
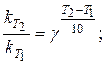
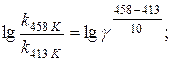
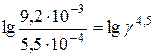
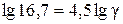
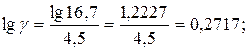
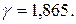
Температурний коефіцієнт реакції дорівнює 1,87.
Приклад 6. Назвати оптимальні умови, необхідні для збільшення виходу продуктів реакції в системі:
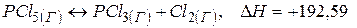 кДж/моль.
кДж/моль.
Відповідь: Напрямок зміщення рівноваги визначається за принципом Ле Шательє: якщо на систему, що перебуває у стані рівноваги, чиниться будь-який зовнішній вплив, то він сприяє перебігу тієї з двох протилежних реакцій, яка протидіє цьому впливу.
а) Оскільки реакція розкладу 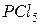 ендотермічна
ендотермічна 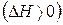 , то для зміщення стану рівноваги в бік прямої реакції треба підвищити температуру.
, то для зміщення стану рівноваги в бік прямої реакції треба підвищити температуру.
|
|
|
б) Оскільки в цій системі розклад 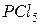 веде до збільшення об’єму (з однієї молекули газу утворюються дві газоподібні молекули), то для зміщення стану рівноваги в бік прямої реакції треба зменшити тиск.
веде до збільшення об’єму (з однієї молекули газу утворюються дві газоподібні молекули), то для зміщення стану рівноваги в бік прямої реакції треба зменшити тиск.
в) Зміщення стану рівноваги в бік прямої реакції можна досягти як збільшенням концентрації 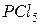 , так і зменшенням концентрацій
, так і зменшенням концентрацій 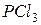 або
або 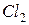 .
.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 518; Нарушение авторских прав?; Мы поможем в написании вашей работы!