
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні рекомендації. Позааудиторна самостійна робота № 10
|
|
|
|
План
Позааудиторна самостійна робота № 10
ІІІ рівень
ІІ рівень
І рівень
Методичні рекомендації
1. При ознайомленні з першим питанням розглянути схему виникнення дифузійного потенціалу.
2. При розгляді другого питання, звернути увагу на причини виникнення мембранного потенціалу.
3. При опрацюванні третього питання. законспектувати визначення потенціалу дії та потенціалу спокою.
4. При розгляді четвертого питання ознайомитися із застосуванням даних явищ у медичній практиці.
Запитання для самоперевірки:
1. Охарактеризувати дифузійний потенціал та механізм його виникнення.
2. Який чинник призводить до виникнення мембранного потенціалу?
3. Що таке потенціал дії та потенціал спокою?
4. Для чого в медичній практиці використовуються потенціали дії?
Тести для самоконтролю
1. Причиною виникнення дифузійного потенціалу є:
а) різниця осмотичних тисків розчинів; б) різниця напруг; в) різниця швидкості руху йонів.
2. Мембранний та дифузійний потенціали призводять до виникнення у клітині:
а) біоструму; б) буферного розчину; в) в’язкості; г) напруги.
3. Потенціал спокою у клітині становить:
а) 50 – 100 В; б) 100 – 200 мВ; в) 50 – 100 мВ; г) 150 – 200 мВ.
4.Мембрана клітини у спокої більш проникна для йонів:
а) Ca2+; б) Na+; в) K+; г) Mg2+.
5. Раптове підвищення та падіння мембранного потенціалу називається:
а)потенціалом спокою; б)дифузійним потенціалом; в) контактним потенціалом; г) потенціалом дії.
6.Здатність тканин організму утворювати потенціал дії використовується в медицині для:
а) рН – метрії; б) електрокардіографії; в) гемодіалізу.
7. Для зменшення дифузійного потенціалу використовують сифон з розчином:
а) CaCl2; б) Cu(NO3)2; в) KCl; г) Na2SO4.
|
|
|
Тема: Розв’язування задач за індивідуальними завданнями з тем „Розчини” та „Електрохімія”
1. Основні поняття і формули, які використовуються при розв’язанні задач на розчини.
2. Електропровідність розчинів електролітів та величини, які її характеризують. Закони Фарадея.
Час виконання: 1 година
Мета роботи: навчитися розв’язувати розрахункові задачі по темах „Розчини” та „Електрохімія”
Важливою характеристикою розчину є його кількісний склад, тобто вміст розчиненої речовини у певній кількості розчину або розчинника. Склад розчину можна виразити як часткою розчиненої речовини, так і концентрацією розчиненої речовини.
Під масовою часткою розчиненої речовини розуміють відношення маси розчиненої речовини до маси розчину:
W = 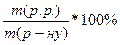
Молярна концентрація (СМ) – це відношення кількості розчиненої речовини 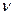 до об’єму розчину(в дм3, л, м3):
до об’єму розчину(в дм3, л, м3):
СМ =  =
= 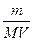 , де т – маса розчиненої речовини, г; М – молярна масарозчиненої речовини ,г/моль;V – об’єм розчину, дм3, м3, л.
, де т – маса розчиненої речовини, г; М – молярна масарозчиненої речовини ,г/моль;V – об’єм розчину, дм3, м3, л.
Оскільки об’єм розчину дорівнює відношенню маси розчину до густини, яку виражають в кг/м3 або г/см3 (г/мл):
V =  , то, підставивши цей вираз у першу формулу, одержимо:
, то, підставивши цей вираз у першу формулу, одержимо:
СМ =  .
.
Молярну концентрацію позначають літерою М, наприклад, запис 0,25М означає, що в 1 л розчину міститься 0,25 моль розчиненої речовини.
Молярна концентрація еквівалента (Секв) (нормальність (СН) – це відношення кількості еквівалентів розчиненої речовини (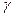 екв) до об’єму розчину в дм3(м3, л).:
екв) до об’єму розчину в дм3(м3, л).:
Секв=  =
= 
Молярна маса еквіваленту показує, яка маса речовини еквівалентна (або реагує з 1 г Гідрогену або з 8 г Оксигену). Вона дорівнює добутку її молярної маси МВ (в г/моль) на фактор еквівалентності fекв:
Мекв = МВfекв
Фактор еквівалентності показує, яка частка моля речовини реагує, тобто еквівалентна 1 моль атомів Гідрогену у певній реакції.
Для кислоти молярна маса еквіваленту дорівнює молярній масі кислоти, поділеній на її основність, тобто на число атомів Гідрогену, що входять до її складу. Наприклад, для сульфатної кислоти H2SO4:
|
|
|
Мекв = 98: 2 = 49 г/моль; Мекв(HCl) = 36,5: 1 = 36,5 г/моль
Для основи молярна маса еквіваленту дорівнює молярній масі основи, поділеній на ступінь окиснення металу:
Мекв(NaOH) = 40;1 = 40 г/моль; Мекв(Ca(OH)2) = 74:2 = 37.г/моль
Для того, щоб знайти молярну масу еквіваленту солі, необхідно її молярну масу поділити на ступінь окиснення металу і число його атомів:
Мекв(Al2(SO4)3) =  =57 г/моль, де 3 – ступінь окиснення алюмінію, а 2 – число атомів алюмінію.
=57 г/моль, де 3 – ступінь окиснення алюмінію, а 2 – число атомів алюмінію.
Задача 1. Обчислити молярну концентрацію сульфатної кислоти у розчині, якщо масова частка кислоти в ньому 63%, а густина розчину – 1,53 г/мл.
Дано: W = 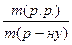 ∙100%; m(p.p.) =
∙100%; m(p.p.) =  ;
;
W(H2SO4) = 63%; CM =  =
= 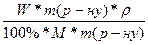 =
= 
 = 1,53г/мл. 1. Яка молярна концентрація розчину?
= 1,53г/мл. 1. Яка молярна концентрація розчину?
Знайти: СМ =  = 9,84 моль/л
= 9,84 моль/л
СМ -?
M(H2SO4) = 98г/моль
Задача 2. Яка масова частка HNO3 у 12,2М розчині нітратної кислоти густиною 1,35 г/мл?
Дано: W = 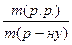 ∙ 100%; V =
∙ 100%; V =  ;
;
СМ = 12,2М; CM =  ; m(p.p.) =
; m(p.p.) = 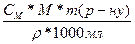
 = 1,35 г/мл W =
= 1,35 г/мл W =  ∙100% =
∙100% = 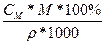 =
=
Знайти: = 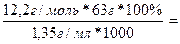 56,93%
56,93%
W(HNO3) -?
M(HNO3) = 63 г/моль
Електроліз – цеокисно – відновні реакції, які перебігають під дією постійного електричного струму на електродах гальванічної ванни.
Кількісно процеси електролізу описують у відповідності із законами Фарадея.
Перший закон Фарадея: маса речовини, яка виділяється при електролізі, прямо пропорційна кількості електрики, що пройшла крізь електроліт:
m = kQ = kIt,
де Q – кількість електрики, Кл; k – електрохімічний еквівалент, г/А; I – сила струму, А; t – час. С.
Електрохімічним еквівалентом називають масу речовини, яка виділяється на електроді при пропусканні одиниці кількості електрики. За одиницю кількості електрики прийнятий 1 Кл = 1 А*с.
Другий закон Фарадея: при пропусканні однакової кількості електрики крізь розчини або розплави різних електролітів маси речовин, які виділилися на електродах, пропорційні їх еквівалентним масам:
 =
=  .
.
Враховуючи перший закон Фарадея, записують:
 .
.
Відношення еквівалентної маси будь – якої речовини до його електрохімічного еквівалента є постійною Фарадея, яка дорівнює 96500 Кл.
Обидва закони поєднують загальною формулою:
m = 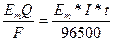
Задача 3. Крізь розчин купрум (ІІ) хлориду на протязі 3 годин пропускали струм силою 5 А. Визначити масу міді, що виділилась на катоді.
|
|
|
Дано:
t = 3 год; 1. Визначаємо масу міді:
І = 5 А. CuCl2  Сu0 + Cl20
Сu0 + Cl20
Знайти: m = kIt = 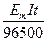 ; Em =
; Em = 
 m =
m =  =17,9 г
=17,9 г
m(Cu) -?
Ar(Cu) = 64
Питома електрична провідність 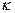 - це провідність 1 м3 розчину електроліту, розміщеного між двома електродами, що мають площу 1 м2 і віддалені один від одного на відстань 1 м.
- це провідність 1 м3 розчину електроліту, розміщеного між двома електродами, що мають площу 1 м2 і віддалені один від одного на відстань 1 м.
Питома електрична провідність обернено пропорційна питомому опору  шару електроліту:
шару електроліту:
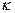 =
= 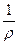 , і її розмірність См*м-1.
, і її розмірність См*м-1.
Опір розчину визначають за формулою:
R = 
 , де l – відстань між електродами кондуктометричної комірки, м; S – їх площа, м2;
, де l – відстань між електродами кондуктометричної комірки, м; S – їх площа, м2;  - питомий опір розчину, Ом.
- питомий опір розчину, Ом.
Оскільки, питомий опір – це величина, обернена до питомої електричної провідності, а відношення l/S – константа кондуктометричної комірки К, то рівняння можна записати так:
R = 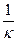 K =
K =  , звідки
, звідки 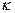 =
= 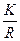 .
.
Молярною електричною провідністю  с називають електричну провідність об’єму розчину в 1 м3, у якому розчинено 1 моль електроліту, розміщеного між електродами, відстань між якими дорівнює 1 м:
с називають електричну провідність об’єму розчину в 1 м3, у якому розчинено 1 моль електроліту, розміщеного між електродами, відстань між якими дорівнює 1 м:
 =
=  , коефіцієнт 1000 потрібний для перерахунку молярної концентрації в моль/м3. Розмірність молярної електричної провідності См*моль-1 ∙ м2.
, коефіцієнт 1000 потрібний для перерахунку молярної концентрації в моль/м3. Розмірність молярної електричної провідності См*моль-1 ∙ м2.
Задача 4. В посудину для вимірювання питомої електричної провідності помістили круглі платинові електроди діаметром 2,26 см. Відстань між ними 1,68 см. Посудина заповнена 0,01М розчином NaNO3. При напрузі 0,5 В через даний розчин проходить струм силою 1,17 мА. Знайти питому і молярну електричні провідності NaNO3.
Дано:
d = 2,26 см = 2,26*10-2м. 1.Знаходимо константу кондуктометричної
l = 1,68 см = 1,68*10-2м комірки К:
СМ = 0,01М К =  ; площа круга Sкруга =
; площа круга Sкруга = 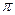 R2
R2
U = 0,5 B Sкруга = 3,14 ∙ (1,13 ∙ 10-2)2 = 4∙ 10-4м2
I = 1,17 мА = 1,17*10-3А К =  = 0,42 ∙102 м-1
= 0,42 ∙102 м-1
Знайти: 2. За законом Ома знаходимо опір
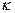 -? розчину:
-? розчину:
 -? R =
-? R =  =
=  = 427,4 Ом = 4,274 ∙102Ом
= 427,4 Ом = 4,274 ∙102Ом
3. Знаходимо питому електропровідність:
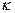 =
= 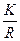 =
=  = 9,8∙10-2 См ∙ м-1
= 9,8∙10-2 См ∙ м-1
4.Знаходимо молярну електропровідність:
 =
=  =
= 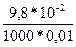 = 9,8 ∙10-3См ∙ моль-1 ∙м2
= 9,8 ∙10-3См ∙ моль-1 ∙м2
1. При розгляді першого питання повторити основні поняття і формули, які використовуються при розв’язанні задач по темі „Розчини”.
2. При розгляді другого питання скласти опорний конспект.
3. Ознайомитися з алгоритмом розв’язування задач по темі „Електрохімія”
|
|
|
Запитання для самоперевірки:
1. Як можна виразити кількісний склад розчину?
2. Що таке електроліз? електрохімічний еквівалент?
3. Сформулювати закони Фарадея.
4. Що таке питома та еквівалентна електричні провідності?
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 895; Нарушение авторских прав?; Мы поможем в написании вашей работы!