
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентний зв’язок. Метод валентних зв’язків
|
|
|
|
Умова утворення хімічного зв’язку
Тема 4. Хімічний зв’язок і будова речовин
При взаємодії атомів між ними може виникнути хімічний зв’язок, який призводить до утворення багатоатомної стійкої системи-молекули, молекулярного йона або кристала. В більшості випадків структурними одиницями речовини є молекули.
Хімічний зв’язок має електричну природу і виникає внаслідок взаємодії електричних полів, які створюються електронами і ядрами атомів, що беруть участь в утворенні молекули або кристала, в тому випадку, коли при зближенні атомів повна енергія системи (сума кінетичної і потенціальної енергій) понижується. Отже, при утворенні хімічного зв’язку енергія завжди виділяється. Наприклад, Н + Н = Н2 + 436 кДж.
Важливою характеристикою хімічного зв'язку є енергія зв’язку, яка визначає його міцність.
Кількість енергії, що виділяється при утворенні хімічного зв’язку, називається енергією зв’язку.
Її виражають в кілоджоулях на 1 моль речовини, яка утворюється. Чим більша енергія зв’язку, тим міцніший зв’язок і тим більше енергії потрібно для його розриву. Розглянемо це на прикладі гідроген галогенідів:
| Зв’язок | H-F | H-Cl | H-Br | H-I |
| Е, кДж/моль |
Отже, найміцнішим з цих зв’язків є H-F, для нього енергія зв'язку має найбільше значення.
Важливою геометричною характеристикою хімічного зв’язку є його довжина.
Довжиною хімічного зв’язку називають відстань між ядрами атомів в молекулі. Її визначають експериментально з допомогою молекулярної спектроскопії, дифракції рентгенівських променів тощо. Наприклад, довжина зв’язків в молекулах гідроген галогенідів має такі значення:
| Молекула | H-F | H-Cl | H-Br | H-I |
| Довжина зв’язку, нм | 0,092 | 0,128 | 0,142 | 0,162 |
|
|
|
Із зростанням атомного номера і відповідно розміру атома галогена довжина його хімічного зв’язку з Гідрогеном зростає.
Таким чином, хімічний зв’язок утворюється за рахунок електростатичної взаємодії позитивно заряджених ядер і негативно заряджених електронів при умові зменшення потенціальної енергії системи взаємодіючих атомів.
В 1916 р. американський фізико-хімік Гілберт Льюїс зробив спробу пояснити механізм утворення хімічного зв’язку між взаємодіючими атомами. У відповідності з його теорією хімічний зв’язок виникає за рахунок утворення електронної пари, яка одночасно належить обом атомам.
В 1927 р. англійські вчені В.Гейтлер і Ф.Лондон зробили квантово-механічний розрахунок для молекули водню. Вони вивели залежність потенціальної енергії системи від відстані між ядрами атомів Гідрогену (рис. 5).
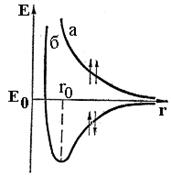
Рис. 5. Енергія системи, що складається з двох атомів Гідрогену:
а – при однаково напрямлених спінах електронів;
б- при протилежно напрямлених спінах;
Е0 – енергія системи з двох невзаємодіючих атомів Гідрогену;
r0 - між’ядерна відстань у молекулі водню
При зближенні атомів, які мають паралельні спіни електронів, відбувається безперервне зростання енергії системи. У цьому випадку для зближення атомів потрібна затрата енергії, тому такий процес виявляється енергетично невигідним, і хімічний зв’язок не утворюється.
Зближення атомів з антипаралельними спінами електронів супроводжується зменшенням енергії до деякої відстані між ядрами (довжини зв’язку), яка дорівнює для атомів Гідрогену 0,074 нм. При такій відстані система має найменшу потенціальну енергію, що свідчить про утворення молекули Н2. Подальше зближення атомів знову призводить до зростання енергії.
Отже, В.Гейтлер і Ф.Лондон показали, що в утворенні хімічного зв’язку можуть брати участь тільки електрони з протилежно напрямленими спінами. Окрім того, утворення хімічного зв’язку між атомами Гідрогену є результатом „перекривання” електронних хмар, яке відбувається при наближенні взаємодіючих атомів. Про це свідчить той факт, що відстань між ядрами менша подвоєного радіуса атома Гідрогену (0,106 нм) (рис. 5).
|
|
|
Електронна густина в між’ядерному просторі зростає, позитивно заряджені ядра притягаються до області перекривання електронних хмар і утворюється стійка молекула.
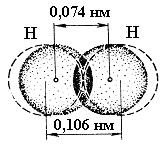
Рис. 6. Схема перекривання електронних хмар при утворенні молекули водню
Отже, дослідження В.Гейтлера і Ф.Лондона давало змогу зробити висновок, що хімічний зв’язок у молекулі водню здійснюється за допомогою утворення пари електронів з протилежно напрямленими спінами, яка належить обом атомам. Процес утворення молекули водню можна подати такою схемою:
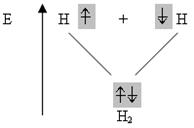
З схеми видно, що молекулярний енергетичний рівень нижчий за вихідні атомні рівні, отже, молекулярний стан речовини більш стійкий, ніж атомний.
Такий двоелектронний двоцентровий (двоядерний) зв’язок називають ковалентним зв’язком.
Уявлення про механізм утворення хімічного зв’язку, розвинуті В.Гейтлером і Ф.Лондоном на прикладі молекули водню, були поширені Слейтером і Полінгом в 30-х роках ХХ ст. і на більш складні молекули. Розвинута на цій основі теорія хімічного зв’язку одержала назву метода валентних зв’язків (ВЗ). Метод ВЗ дав теоретичне обґрунтування найважливіших властивостей ковалентного зв’язку, дозволив зрозуміти будову великої кількості молекул, хоч і не став універсальним.
В основі методу ВЗ лежать такі положення:
1) Ковалентний хімічний зв’язок утворюється двома електронами з протилежно напрямленими спінами, і ця електронна пара належить обом атомам.
2) Ковалентний зв’язок тим міцніший, чим більшою мірою перекриваються електронні хмари.
3) Комбінації двоелектронних двоцентрових зв’язків, які відображують електронну структуру молекул, називаються валентними схемами.
Для наочного зображення валентних схем валентні електрони позначають крапками. Наприклад, утворення молекул водню і азоту можна показати такими валентними схемами:
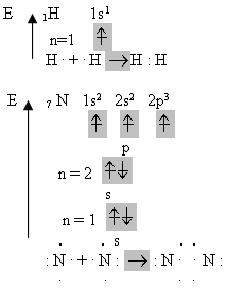
Атоми Гідрогену мають на зовнішньому енергетичному рівні по одному неспареному електрону, тому між ними утворюється один зв’язок, а між атомами Нітрогену виникає три зв’язки через наявність трьох неспарених електронів.
|
|
|
Кількість спільних електронних пар, які з’єднують атом з іншими атомами, тобто число ковалентних зв’язків, які утворює атом, називають ковалентністю або валентністю елемента в сполуці.
Валентність Гідрогену дорівнює одиниці, а Нітрогену – трьом.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2377; Нарушение авторских прав?; Мы поможем в написании вашей работы!