
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика виконання роботи
|
|
|
|
Самостійна робота на занятті.
Контрольні питання.
Тема: Дослідження води.
Актуальність теми: Найбільш поширена на Землі речовина – вода, відіграє важливу роль для життєдіяльності людини. Вода не є ідеально чистою речовиною. В ній містяться розчинені гази (О2, N2, CО2), багато катіонів (Na+, K+, Mg2+, Ca2 +), а також аніони (CI-, SO42-, НСО3-). Якісною є питна вода в якій концентрація деяких йонів не перевищують допустимі норми. Значення цих норм, а також вміння оцінювати якість питної води мають важливе значення для практичної діяльності лікаря.
Навчальні цілі:
Знати: допустимі концентрації вмісту найважливіших йонів в питній воді.
Вміти: визначати тимчасову, загальну і постійну твердість води.
Самостійна позааудиторна робота студентів.
1. Поширення води в природі.
2. Показники якості питної води.
3. Твердість води і фактори, які зумовлюють її.
4. Види твердості води, одиниці вимірювання.
5. Способи усунення твердості води.
6. Способи визначення загальної та постійної твердості води.
7. Методи очистки води. Витрати прісної води на Землі.
8. Визначення тимчасової твердості води методом нейтралізації.
9. Застосування комплексонометричного методу у встановленні загальної твердості води. Суть методу.
1. Що таке точка еквівалентності? Основний закон еквівалентності
2. Який стандартний розчин застосовують в методі нейтралізації, методі комплексонометрії?
3. Розрахувати молярну масу еквівалента CaSO4, Ca(HCO3)2, Mg(HCO3)2, MgSO4
4. Яка маса Ca2+ міститься в 1 л води, якщо його молярна концентрація становить 1 ммоль-екв/л?
5. При випарювані 1 л води одержано 450 мг сухого залишку. Вирахувати загальну та постійну твердість води, якщо 75 % сухого залишку складає сульфат кальцію, а 25 % карбонат кальцію.
|
|
|
6. Постійна твердість води 3,5 ммоль-екв/л. Яку масу Na2CO3 10Н2O треба додати до 20 мл води, щоб усунути її твердість?
Виконати лабораторні роботи:
1. Визначення тимчасової твердості води.
2. Визначення загальної твердості води.
3. Визначення постійної твердості і висновок про твердість води.
Робота 1. Визначення тимчасової твердості води.
Твердість води зумовлена наявністю розчинних солей кальцію і магнію. Розрізняють тимчасову і постійну твердість. Тимчасова твердість обумовлена наявністю у воді гідрокарбонатів кальцію і магнію. Вона усувається при кип’ятінні.
t
Са(НСО3)2→ СаСО3↓+CO2+H2O
Постійна твердість обумовлена наявністю розчинних солей кальцію і магнію, і усувається хімічним шляхом під дією соди.
СаСІ2+Na2CO3→CaCO3+2NaCI
Визначення тимчасової твердості проводять методом нейтралізації гідрокарбонатів стандартним розчином НСІ. В точці еквівалентності, коли змінюється колір індикатору метилоранжу
 , а значить
, а значить
 ммоль*екв./л
ммоль*екв./л
В конічну колбу відмірюють 50 мл досліджуваної води і титрують розчином НСІ (Се =0,1 моль/л) в присутності індикатора метилоранжу до переходу жовтого забарвлення в червоне. Паралельних титрувань повинно бути не менше трьох. Результати заносять в таблицю.
| № п/п | 
| VHCI | Ce(HCI) | 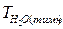
|
Визначають середнє значення об’єму робочого розчину НСІ і за цим значенням вираховують  за рівнянням:
за рівнянням:

Робота 2. Визначення загальної і постійної твердості води.
Визначення загальної твердості води обумовлена здатністю розчину динатрієвої солі етилендиамінтетраоцтової кислоти (ЕДТА), відомою під назвою трилон Б, утворювати стійкий комплекс з Са2+ і Мg2+. Точку еквівалентності встановлюють за допомогою індикатора хромогену темносинього. В цій точці:

звідки: 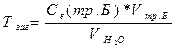
В конічну колбочку відмірюють 5 мл досліджуваної води, додають 6-8 капель аміачного буферу (рН =10,0), 2-4 краплі індикатора хромогену темносинього і титрують розчином трилону Б (Ce =0,01 моль/л) від фіолетового до синього забарвлення розчину. Дані заносять в таблицю.
|
|
|
| п/п | 
| Vтр.Б | Ce(тр.Б) | 
|
 *1000
*1000
Постійну твердість води розраховують, як різницю між загальною і тимчасовою твердістю.

Тверда вода це вода в якій концентрація розчинених солей більше 7 ммоль/л.
Зробити висновок про твердість досліджуваної води.
Заняття 8
Тема: Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
Актуальність теми: Біохімічні процеси в організмі людини проходять у водних розчинах. При цьому водне середовище може бути нейтральним, кислим чи основним. Організм успішно справляється з кислотно-основною рівновагою і рН біологічних рідин залишається сталим, що забезпечує його нормальний життєвий рівень. Знання рН біологічних рідин дозволяє виявити патологічні зміни в організмі, попереджувати хвороби.
Навчальні цілі:
Знати: Значення рН шлункового соку, слини і інших біологічних рідин, від чого залежить значення рН різних розчинів.
Вміти: Визначати рН розчинів за допомогою індикаторів. Розраховувати теоретичне значення рН різних розчинів.
Самостійна позааудиторна робота студентів.
1. Сильні і слабкі електроліти. Ступінь і константа дисоціації.
2. Закон розведення Оствальда.
3. Протолітична теорія кислот і основ
4. Електролітична дисоціація води. Іонний добуток води.
5. Водневий показник розчинів (рН).
6. рН біологічних рідин (крові, жовчі, сечі, слюни),їхзначення в здоровому організмі.
7. Кислотно-основні індикатори. Універсальний індикатор.
8. Межі рН для питної води, їх визначення.
9. Роль концентрації водневих іонів в біологічних процесах.
Контрольні питання.
1.Як визначити ступінь дисоціації?
2.Що таке константа дисоціації? Напишіть її вираз для карбонатної кислоти.
3.Закон розведення Оствальда.
4.Напишіть рівняння і константу дисоціації води.
5.Що таке йонний добуток води?
6.Що таке водневий показник розчину?
7.Які значення рН в кислих, лужних і нейтральних розчинах?
8.Що таке активність розчину?
9.Як визначити йонну силу розчину?
10.Який зв’язок між активністю і йонною силою розчину?
|
|
|
11.Дайте визначення кислот і основ з точки зору протонної теорії.
12.Напишіть рівняння гідролізу соди.
13.Концентрація водневих йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище.
14.Концентрація гідроксильних йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище.
15.Обчисліть рН розчину оцтової кислоти, хлоридної кислоти та гідроксиду амонію з молярною концентрацією еквівалентів 0,01 моль/л.
Самостійна робота на занятті.
Виконати лабораторні роботи:
1. Визначити рН різних розчинів за допомогою індикаторів.
2. Обчислення рН розчинів різних електролітів.
Методика виконання роботи
Робота 1. Приблизне визначення рН розчинів за допомогою індикаторів.
В три пробірки окремо налити по 1 мл води, розчинів кислоти і лугу. Дані розчини окремо випробувати універсальним індикатором, фенолфталеїном і метилоранжем, приливаючи в кожну пробірку по 2-3 краплі індикатора. Спостереження внести в таблицю, вказуючи зміну забарвлення індикатора.
| електроліти | індикатори | |
| універсальний | фенолфталеїн | метилоранж |
Робота 2. Визначення рН розчинів і білогічних рідин за допомогою універсального індикатора.
В окремі пробірки внести по 1 мл даних розчинів кислот, основ, сироватки крові, шлункового соку і визначити універсальним індикатором величину рН.
Одержані дані внести в таблицю:
| Біологічні рідини і розчини електролітів | рН | середовище |
| кисле | лужне | нейтральне |
Робота 3. Обчислення рН розчинів різних електролітів.
В чотири пробірки налити по 4,5 мл води і в кожну із них прилити по 0,5 мл 0,1н розчинів соляної, оцтової кислот, гідроксидів натрію і амонію. За допомогою універсального індикатора визначити рН кожного розчину. Теоретично обчислити концентрацію водневих іонів даних розчинів і їх значення звірити з практично визначеними. Дані оформити у вигляді таблиці:
| Електроліти | Сн | рН | |
| теоретичне | експериментальне | ||
| НСІ | |||
| СН3СООН | |||
| NaOH | |||
| NH4OH |
Записати висновки по кожній роботі.
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 382; Нарушение авторских прав?; Мы поможем в написании вашей работы!