
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. При вивченні цієї теми потрібно добре розуміти фізичний зміст термодинамічних функцій: внутрішньої енергії
При вивченні цієї теми потрібно добре розуміти фізичний зміст термодинамічних функцій: внутрішньої енергії, ентальпії, ентропії та вільної енергії Гіббса.
Ентальпія (Н) і внутрішня енергія (U) характеризують енергетичний стан термодинамічної системи. Вони відрізняються між собою на величину р D V. Це робота, яка виконується при переході системи до ізобарних умов:
Н = U + р D V.
Якщо інших видів роботи не виконується, зміна ентальпії (D Н) внаслідок здійснення процесу дорівнює тепловому ефекту хімічної реакції (Q), але з протилежним знаком. Реакціям, що перебігають з виділенням тепла (Q > 0, екзотермічні реакції), відповідає D Н < 0, а для реакцій з поглинанням тепла (Q < 0, ендотермічні реакції) D Н > 0.
Ентальпія, як і внутрішня енергія, не має абсолютного значення. Значення ентальпії простих речовин, взяті за стандартних умов (р = 1,013 × 105 Па, Т =298 К) у стійких агрегатних станах, умовно прийнято рівними нулю.
Стандартний тепловий ефект реакції (точніше, стандартну зміну ентальпії D Н 0298) записують у правій частині рівняння хімічної реакції після коми. Рівняння хімічних реакцій з указаними значеннями стандартної зміни ентальпії називають термохімічними.
Стандартний тепловий ефект реакції утворення одного моля речовини з простих речовин, які перебувають у стійкому агрегатному стані, називають стандартною ентальпією утворення речовини, D Н 0298(Х), і вимірюють у кДж/моль (див. додаток, табл.2).
Зміна будь-якої термодинамічної функції не залежить від шляху процесу (закон Гесса), а тому розраховується як різниця стандартних значень цієї функції для продуктів реакції та вихідних речовин (наслідок із закону Гесса). При розрахунках теплових ефектів хімічних реакцій необхідно враховувати кількості речовин у молях, позначених відповідними коефіцієнтами перед формулами речовин у рівнянні (i, j):
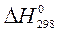 х. р. =
х. р. = 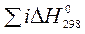
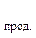 -
- 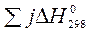
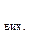 .
.
Приклад. Розрахуйте стандартний тепловий ефект реакції (зміну стандартної ентальпії) згоряння етану, запишіть термохімічне рівняння. Розрахуйте кількість теплоти, яка виділяється, якщо згорає 300 г цього газу. Який об’єм кисню (за н.у.) потрібен для цього?
Розв’язання. Записуємо рівняння реакції згоряння етану:
С2Н6(г.) + 3,5О2(г.) = 2СО2(г.) + 3Н2О(рід.).
Користуючись значеннями стандартних ентальпій утворення сполук (додаток, табл. 2), розраховуємо зміну ентальпії для реакції:
D Н 0298 = 2D Н 0298(СО2) + 3D Н 0298(Н2О) - 1D Н 0298(С2Н6) - 3,5D Н 0298(О2);
D Н 0298 = 2(-394) + 3(-286) - 1(-85) - 3,5 × 0 = -1275 (кДж).
Записуємо термохімічне рівняння:
С2Н6 + 3,5О2 = 2СО2 + 3Н2О, D Н 0298 = -1275 кДж.
Ця реакція екзотермічна, тобто при згорянні одного моля С2Н6 (М = 30 г/моль) виділяється 1275 кДж тепла.
Проводимо розрахунки для 300 г етану:
30 г етану - 1275 кДж
300 г етану - х;
х = Q = 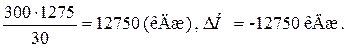
Знаходимо потрібний об’єм кисню:
3,5 × 22,4 л О2 - 1275 кДж
у - 12750 кДж
у = V (О2) = 784 л, або 0,784 м3.
Ентропія (S) – термодинамічна функція, яка характеризує ступінь невпорядкованості системи. Чим більше невпорядкована система, тим більша ентропія. Найбільших значень ця функція набуває для газів. Зміна ентропії для будь-якої реакції розраховується згідно з наслідком закону Гесса, як і зміна ентальпії. Зміну ентропії внаслідок відбування процесів можна оцінювати без розрахунків: збільшення сумарної кількості молів газоподібних речовин при перебігу реакції веде до збільшення невпорядкованості системи, тобто до збільшення ентропії, і навпаки. Наприклад, у розглянутій вище реакції було 4,5 моль вихідних газів (С2Н6 і О2), а утворилось усього 2 моль газу (СО2). Зменшилась кількість молів газів (D n = 2 - 4,5 = -2,5 < 0), отже, зменшилась і ентропія (D S < 0). 
Термодинамічною умовою самодовільного перебігу реакції є зміна функції вільної енергії Гіббса (D G):
D G = D Н - Т D S,
де Т D S – так звана зв’язана енергія, тобто енергія, яка некорисно витрачається суто на збільшення невпорядкованості системи, тоді як D G можна використати на виконання будь-якого типу корисної роботи за винятком роботи по зміні об’єму системи.
Кожна термодинамічна система (конкретна речовина або фізико-хімічний процес) характеризується величиною стандартної вільної енергії Гіббса, 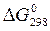 (Х), яка теж (як і ентальпія) є відносною (див. додаток, табл. 3). Зміну
(Х), яка теж (як і ентальпія) є відносною (див. додаток, табл. 3). Зміну 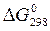 для хімічної реакціїрозраховують також згідно з наслідком із закону Гесса:
для хімічної реакціїрозраховують також згідно з наслідком із закону Гесса:
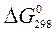 х. р. =
х. р. = 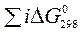
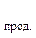 -
- 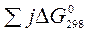
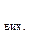 .
.
Якщо 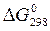 х. р. < 0, реакція перебігає довільно зліва направо і при цьому може виконуватись корисна робота
х. р. < 0, реакція перебігає довільно зліва направо і при цьому може виконуватись корисна робота 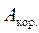 = -
= - 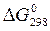 х. р..
х. р..
Можна, не виконуючи розрахунків, а тільки аналізуючи зміни ентальпії та ентропії, робити висновки про можливість довільного перебігу реакції при різних температурах. Наприклад, для реакції згоряння етану відомо з попередніх прикладів, що 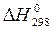 < 0 і
< 0 і 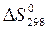 < 0. Отже, Т D S- складова енергії Гіббса (зв’язана енергія) є негативною величиною, а - Т D S - позитивною, тому зниження температури сприяє перебігу прямої реакції, тому що зменшує абсолютну величину зв’язаної енергії і, відповідно, величину енергії Гіббса.
< 0. Отже, Т D S- складова енергії Гіббса (зв’язана енергія) є негативною величиною, а - Т D S - позитивною, тому зниження температури сприяє перебігу прямої реакції, тому що зменшує абсолютну величину зв’язаної енергії і, відповідно, величину енергії Гіббса.
|
|
Дата добавления: 2015-05-24; Просмотров: 385; Нарушение авторских прав?; Мы поможем в написании вашей работы!