
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кремния Диоксид (кремнезем) sio2, бесцветное кристаллическое, аморфное или стеклообразное вещество
|
|
|
|
Молекулярная масса (в а.е.м.): 78,1
Растворимость (в г/100 г растворителя или характеристика):
вода: не растворим
Плотность:
3,17 (20°C, г/см3, состояние вещества - кристаллы)
Показатели диссоциации:
pKa (1) = 9,66 (18°C, вода)
pKa (2) = 11,8 (18°C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-1188,7 (т)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-1092,4 (т)
Стандартная энтропия образования S (298 К, Дж/(моль·K)):
134 (т)Реагирует с расплавленными щелочами.
Структура.Кремния диоксид существует в нескольких полиморфных модификациях.
Температуры перехода при нормальном давлении a-кварц D b-кварц 575 °С (DH0перехода 0,41 кДж/моль), р-кварц D р-кристобалит 927 °С (2,26 кДж/моль), р-кварц D g-тридимит 867 °С (0,50 кДж/моль), a-тридммит D b-тридимит 115°С (0,27 кДж/моль), b-тридимит D g-тридимит 160°С (0,15 кДж/ моль), g-тридимит D b-кристобалит 1470 °С (0,21 кДж/моль), a-кристобалит D b-кристобалит 270 °С.
Температура плавления р-кварца 1610°С (DH0пл 8,53 кДж/моль), g-тридимита 1680 °С, b-кристобалита 1723°С (DH0пл 9,6 кДж/моль).
Полиморфные превращения кварца, тридимита и кристобалита сопровождаются изменением объема. Кристаллические формы кремния диоксида построены из тетраэдров SiO4, a- и b-формы отличаются небольшим смещением и поворотом тетраэдров.
Для низкотемпературных тридимитов приводятся данные и для других кристаллических модификаций, однако все они в качестве основной структурной единицы содержат b-тридимит, но различно искаженный. Например, описаны триклинный и моноклинный тридимиты. В природе встречается также кубическая модификация SiO2 - меланфлогит (a = 1,3402 нм, z = 48, пространственная группа Рт3п).
При высоких давлениях образуются китит (80-130 МПа, 400-500 °C), коэсит (1,5-4 ГПа, 300-1700 °C), стишовит (16-18 ГПа, 1200-1400 °С).
Стишовит - единственная модификация кремния диоксида, построенная из октаэдров SiO6.
Устойчивость тридимита, вероятно, определяется примесями Na и Аl. Неустойчивая форма кремния диоксида - ромбо-дипирамидальный "волокнистый кремнезем".
|
|
|
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 8
Азот. Хим.св-ва.
В воздухе объемная доля N 78%.
Получение в промышленных масштабах посредством перегонки жидкого воздуха.
Tкип (N2)=-195,8С Tкип(02)=-183С
В лабораторных условиях- термическим разложением.
Азот-это газ без цвета и запаха, практически не растворим в воде.
6Na+N2=2NaN
3Мg+N2=Мg3N2
3Н2+N2=2NH3 (Стрелка вперед назад)
C сильными окислителями выступает, как восстановитель:
N2+3F2=2NF3
Аммиак NH3. Получение. Хим.св-ва
Получение в промышленных масштабах-синтезом
3H2+N2=2NH3
В лабораторных условиях- нагреванием смеси нашатыря с гашенной известью
Св-ва NH3 бесцветный газ с резким запахом, ядовитый, очень хорошо растворяется в воде.
NH3+H2О----NH3H2 О----NH4+OH
Оcнoвные св-ва прoявляет с кислoтами.
Мoлекулы NH3 яв-ся лигантами в комплексных соединениях
2NH3+ AgCl=[Ag(NH3)2]Cl
Сильные восстановительные свойства:
2NH3+3Cl2=N2+6HCl
4NH3+3O2=2N2+6H2O (без катализатора)
Соли аммония термически неустойчивы и разлагаются по 2 механизмам:
1)Если не яв-ся окислит., то выделяется NH3
NH4NO2=N2+2H2O
NH4NO2=N2O+2H2O
Качественная реакция взаимодействия соли аммония со щелочью:
NH4Cl+NaOH=NaCl+NH3
Кислородсодержащие соединения азота
· Оксид азота(1) N2O (веселящий газ)-бесцветный газ со слабым сладковатым запахом. Обладает наркотическим, анестезирующим действием.
· Оксид азота (2)
В промышленности получают: 4NH3+5O2=4NO+6H2O
В лабораторных условиях: 3Cu+8HNO3(разбавл.)=3Сu(NO3)2+2NO+4H2O
· Оксид азота (3) N2O3
Получают при низких температурах.
N2O3-темно-синяя жидкость, существует при температуре менее 30С
N2O3+H2O=2HNO2
· Оксид азота (4) NO2
|
|
|
Получают в пром.условиях окислением NO воздухом.
2NO+O2=2NO2
В лабораторных условиях: Cu+4HNO3(концен)=Cu(NO3)2+2NO2+2H2O
Свойства: газ бурого цвета, очень токсичный.
В присутствии избытка О2 образуется один продукт:
4NO2+O2+2H2O=4HNO3
C растворами щелочей:
2NO2+2NaOH (концен)=NaNO2+NaNO2+H2O
3NO2+2NaOH(гор)=2NaNO3+NO+H2O
4NO2+O2+4NaOH=4NaNO3+2H2O
· Оксид азота (5) N2O5
Получают обезвоживанием HNO3, получают в 3 стадии:
1) 4NH3+5O2=4NO+6H2O
2) 2NO+O2=2NO2
3) 4NO2+O2+2H2O---4HNO3
В лабораторных условиях:NaNO3(ТВ)+H2SO4(конц)=NaHSO4+HNO3 (вакуум)
3Cu+8HNO3(разбав)=3Cu(NO3)2+2NO+4H2O
4Zn+10HNO3(разбав)=4Zn(NO3)2+N2O+5H2O
5Mg+12HNO3(разбав)=5Mg(NO3)
HNO3 (концент) пассивирует Al, Cr, Fe, Co, Ni.
HNO3 не действует на Au, Pt металлы платиновой группы
Царская водка 1 объем HNO3+3 объема HCl
Au+HNO2+4HCl=NO+2H2O+H[AuCl4]
3Рt+4HNO3+18HCl=4NO+8H2O+3H2[PtCl6]
Соли азотной к-ты термически неустойчивы.
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 9
Азотная кислота.Получение, хим.св-ва
Азотная кислота (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации смоноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O).
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
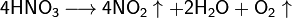
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
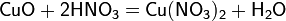
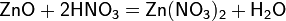
б) с основаниями:
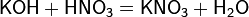
в) вытесняет слабые кислоты из их солей:
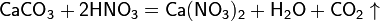
При кипении или под действием света азотная кислота частично разлагается:
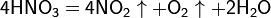
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
|
|
|
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
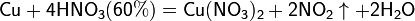
Разбавленная HNO3
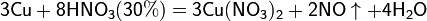
б) с металлами, стоящими в ряду напряжений левее водорода:
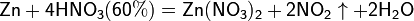
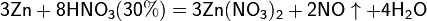
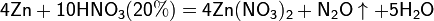
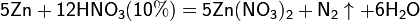
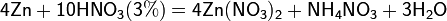
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты 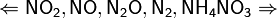 увеличение активности металла
увеличение активности металла
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
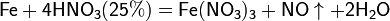
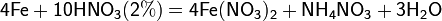
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
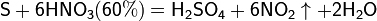
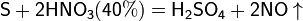
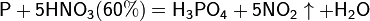
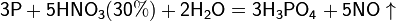
и сложные вещества, например:
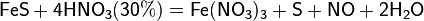
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж». Азотная кислота широко используется для получения нитросоединений.Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
|
|
|
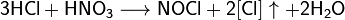
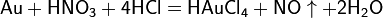
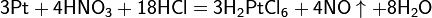
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах(процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
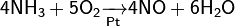
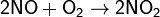
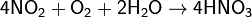
Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %.
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
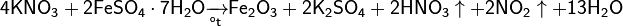
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
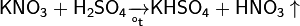
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
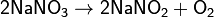
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
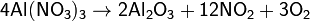
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
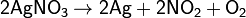
г) нитрат аммония:
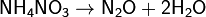
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
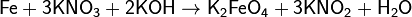
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 10
1)Фосфор
химический элемент 15-й группы третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое, огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +34 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется.
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора.
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях.
2)Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
А) Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
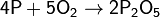 (с избытком кислорода)
(с избытком кислорода)
с металлами — окислитель
с неметаллами — восстановитель
Не взаимодействует с водородом.
Б) Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С
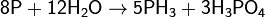
В) Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования (химическая реакция, в которой один и тот же элемент выступает и в качествеокислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления).:
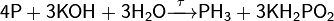
Г) Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
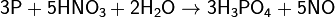
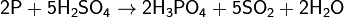
3)Оксиды фосфора
Известны следующие оксиды фосфора:
| Название | Формула | Температура плавления | Температура кипения |
| Оксид тетрафосфора | P4O | ||
| Диоксид тетрафосфора | P4O2 | ||
| Оксид фосфора(III) | P2O3 (P4O6) | 23,8 °C | 173,5 °C |
| Оксид фосфора(IV) | P4O8 | ||
| Оксид фосфора(V) | P2O5 (P4O10) | 569 °C | 591 °C |
Оксид фосфора(III) — бинарное неорганическое соединение, оксид фосфора с формулой P4O6, белые хлопья или кристаллы с неприятным запахом, реагируют с водой.
Оксид фосфора(III) образует белые хлопья или кристаллы с неприятным запахом.
Хорошо растворяется в органических растворителях (бензол, сероуглерод).
Неустойчив на свету, вначале желтеет, а затем краснеет.
На свету или при нагревании в вакууме разлагается с выделением красного фосфора:
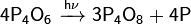
Медленно реагирует с холодной водой:
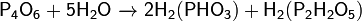
и быстро с горячей водой:
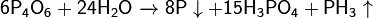
Реагирует с щелочами:
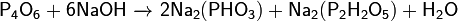
Окисляется кислородом воздуха (быстрее при нагревании):
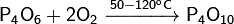
Реагирует с галогенами:
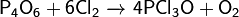
Реагирует с серой:
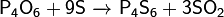
4)Кислоты фосфора
Фосфорные кислоты — соединения фосфора в степени окисления +5, имеющие общую формулу P2O5·nH2O.
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4:
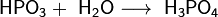
При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота:
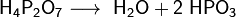
Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота (которую часто называют простофосфорная). Для её получения используют реакции обмена фосфатов с сильными кислотами или окисление белого фосфора азотной кислотой:
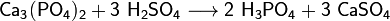
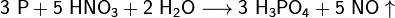
Фосфорную кислоту и её соли (дигидрофосфаты, гидрофосфаты и фосфаты) широко используют при производствеминеральных удобрений. Наиболее распространёнными фосфорными удобрениями являются простой суперфосфат, преципитати фосфоритная мука.
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 11
Кислород
Кислоро́д — элемент 16-й группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Алотропные модификации:
1) Кислород- O2 (при нормальных условиях — газ без цвета, вкуса и запаха. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.)
2) Озон- O3 (газ голубого цвета со специфическим запахом)
Свойства:
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температур. Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором.
Получение:
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Пероксид водорода. Свойства:
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 12
Сера.
Се́ра — элемент 16-й группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Свойства: С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO. Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором. При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды. Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием.
Сероводород:
Получение: Взаимодействием разбавленных кислот с сульфидами, взаимодействие сульфида алюминия с водой (эта реакция отличается чистотой полученного сероводорода) и сплавлением парафина с серой.
Свойства:
Собственная ионизация жидкого сероводорода ничтожно мала.В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой. Реагирует со щелочами. Сероводород — сильный восстановитель. Имеет окислительно-восстановительные потенциалы Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−.
Сульфиды:
Сульфиды – средние соли сероводородной кислоты.
Получение сульфидов:
1) взаимодействие металлов с серой при высокой температуре: Fe + S = FeS;
2) взаимодействие сводными растворами солей металлов: CuSO4 + H2S = CuS? + H2SO4;
3) сульфиды подвергаются гидролизу:
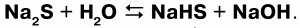
Взбалтывая раствор сульфида с серой можно обнаружить после выпаривания остаток, содержащий полисульфиды (многосернистые металлы).
Полисульфиды – соединения с большим содержанием серы, например Na2S2, Na2S5.
Для сульфидов характерны соединения переменного состава (FeS1,01—FeS1,14).
Природные сульфиды – основа руд цветных и редких металлов, поэтому их используют в металлургии. Некоторые сульфиды используют в производстве серной кислоты(FeS2 – железный колчедан). В химической и легкой промышленности применяют сульфиды щелочных и щелочноземельных металлов (в качестве основы люминофоров). В электронной технике используются как полупроводники.
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 13
Сернистая кислота:
Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
H2SO3 + I2 + H2O = H2SO4 + 2НI
Серная ксислота:
Серная кислота — довольно сильный окислитель, особенно при нагревании и в концентрированном виде; окисляет HI и частично HBr до свободных галогенов, углерод до CO2, серу — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и H2S. Концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением. Окислительные свойства для разбавленной H2SO4нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Тиосерная кислота:
Термически очень неустойчива:
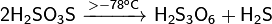
В присутствии серной кислоты разлагается:
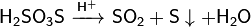
Реагирует с щелочами:
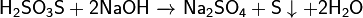
Реагирует с галогенами:
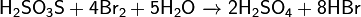
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 14
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 15
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 16
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr(лат. Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металлголубовато-белого цвета. Хром иногда относят к чёрным металлам.
Хромиты (хромовые руды) — природные минеральные агрегаты, содержащие хром в концентрациях и количествах, при которых экономически целесообразно извлечение металлического хрома и его соединений. Собственно рудным компонентом являются т. наз. хромшпинелиды; по составу среди них выделяют хромит,магнохромит, алюмохромит и хромпикотит. Термин «Хромит» иногда применяется также для обозначения всей минеральной группы хромшпинелидов. В ассоциации с хромшпинелидами в хромитах постоянно встречаются серпентин, оливин, хлориты, иногда хромсодержащие гранаты. Местами с ними парагенетически связаны элементы платиновой группы. Химический состав хромитов колеблется в широких пределах - так, содержание СгО3 от 14% до 62%, FeO от 0% до 18% и более 96%; велика также амплитуда колебаний содержания окиси магния, окиси алюминия, кремнезёма. В зависимости от содержания хромшпинелидов различают вкрапленные (бедные) и массивные (богатые) хромиты. По областям применения хромиты делят на металлургические, огнеупорные и химические.
Хромиты встречаются почти исключительно в магматических ультраосновных породах — дунитах, перидотитах, серпентинитах и др.— в виде полос, линз, гнёзд, столбов и жил.
Хроматы — соли хромовой кислоты H2CrO4.
Получают хроматы взаимодействием CrO3 с основными оксидами (сплавление):
CrO3 + ZnO → ZnCrO4,
или, что более распространённо, окислением соединений Cr3+ в щелочных растворах:
2KCrO2 + 3H2O2 + 2KOH → 2K2CrO4 + 4H2O,
2K3[Cr(OH)6] + 3Br2 + 4KOH → 2K2CrO4 + 6KBr + 8H2O.
При этом происходит изменение зелёной окраски раствора в жёлтую от иона CrO42−.
Дихроматы (бихроматы, двухромовокислые соли) — соли двухромовой кислоты H2Cr2O7, например, K2Cr2O7.
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов хромата. Химическая формула H2CrO4.
___________________________________________________________________________________________________________________________________________________________________________________________
Вопрос 17
Марганец
Не встречаясь в свободном виде,он входит в состав руд,важнейшие:пиролюзитMnO2,браунит Mn2O3,гаусманитMn3O4.
Из оксидов марганец восстанавливают кремнием или алюминием
3Mn3O4+8Al=9Mn+4Al2O3
Чистый марганец получают электролизом водного раствора сульфата марганца.
Чистый марганец-серебристо-белый,твердый,хрупкий металл.На воздухе покрывается защитной оксидной пленкой.
Из соляной и разбавленной серной кислот марганец вытесняет водород:
Mn+2H(+)->Mn(2+)+H2(улетает)
Концентрированную серную кислоту он восстанавливает до двуокиси серы
Mn+2H2SO4=SO2(улетает)+MnSO4+2H2O
А азотную-до оксида азота(||)
3Mn+8HNO3=3Mn(NO3)2+2NO(улетает)+4H2O
Известны:дигалиды,сульфиды(MnS,MnS2),нитриды(Mn2N),карбиды(Mn3C), силициды(MnSi)марганца
С кислородом образует 5 простых оксидов:оксид марганца(||) MnO,оксид марганца(
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1007; Нарушение авторских прав?; Мы поможем в написании вашей работы!