
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементы химической термодинамики и биоэнергетики
|
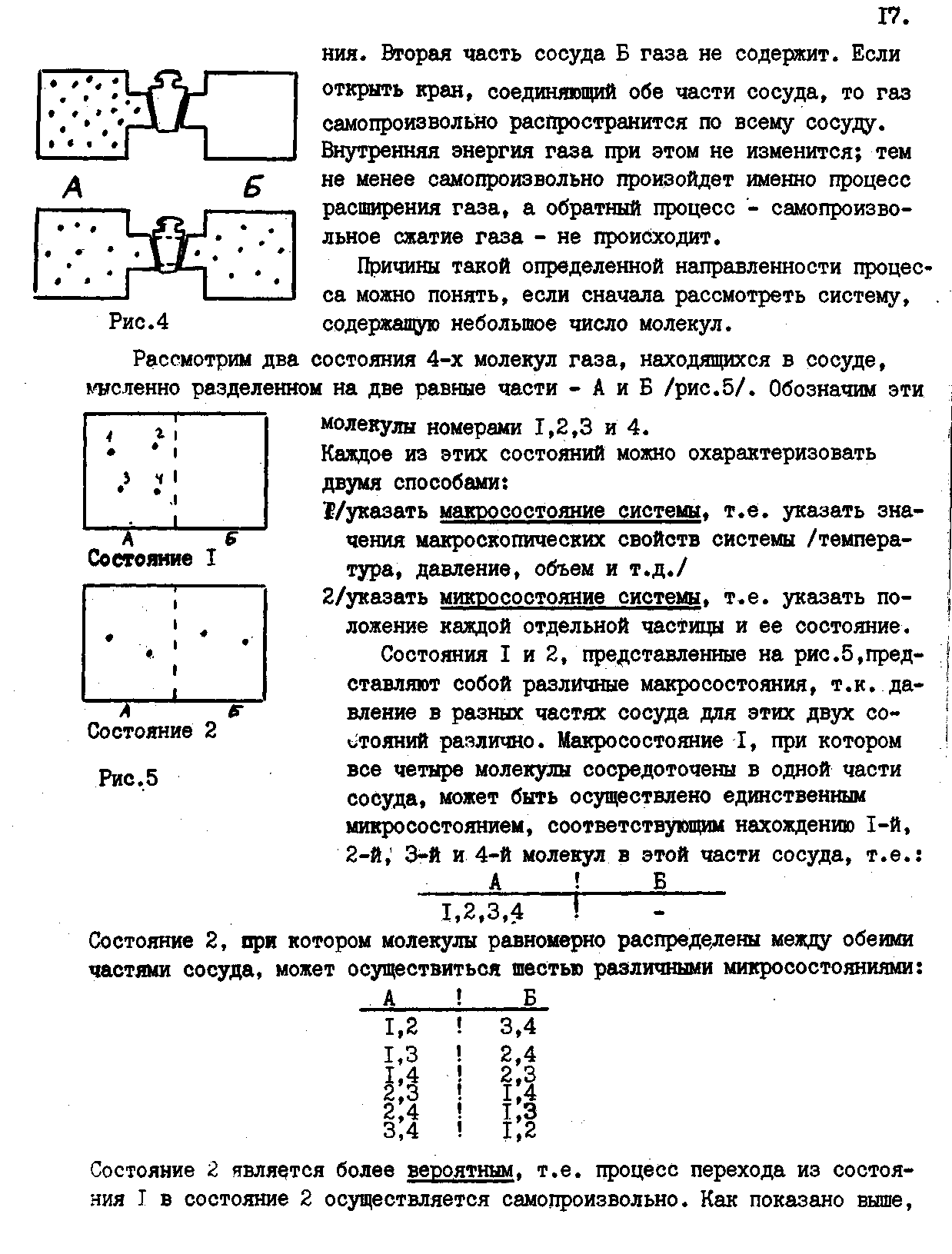
|
|
|
При изучении темы "Элементы химической термодинамики ж биоэнергетики" рекомендуем придерживаться следующего плана:
1. Введение. Предмет и задачи химической термодинамики.
2. Основные понятия н величины химической термодинамики.
3. Тепловые эффекты химических и биохимических процессов.
4. Направление самопроизвольного протекания химических и биохимических процессов.
5. Химическое равновесие с точки зрения термодинамики.
6. Некоторые приложения химической термодинамики к исследованию процессов в живых организмах.
I. ВВЕДЕНИЕ. ПРЕДМЕТ И ЗАДАЧИ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.
При протекании химических реакций происходит не только превращение одних веществ в другие, но и взаимное превращение различных видов энергии. Так, например, реакции горения сопровождаются излучением тепловой и световой энергии. За счет энергии, выделяющейся в ходе биохимических окислительно-восстановительных реакций, существуют живые организмы.
В процессе любой химической или биохимической реакции имеет место какой-либо из двух типов взаимного превращения энергии:
а/ химическая энергия, аккумулированная в исходных веществах, переходит в какую-то другую форму энергии /тепловую, световую, механическую, электрическую и пр./; б/ энергия извне в той или иной форме в ходе реакции поглощается реакционной смесью и переходит в химическую энергию /энергию химических связей/, аккумулирующуюся в продуктах реакции.
/ Вспомните известные вам примеры реакций, иллюстрирующих оба типа превращения энергии./
Наиболее распространенной формой энергии, выделяющейся или поглощающейся при протекании химических реакций, является тепловая энергия. __ Реакции, идущие с выделением тепла, называются экзотермическими. Реакции, сопровождающиеся поглощением тепла из окружающей среды, называются эндотермическими.
|
|
|
Определение тепловых эффектов химических процессов, установление зависимости величины тепловых эффектов реакций от условий проведения реакций - это первая из рассматриваемых в этих рекомендациях задач химической термодинамики.
С энергетикой химических процессов непосредственно связан и вопрос о возможности их самопроизвольного протекания. Например, цинк, опущенный в раствор сульфата меди, самопроизвольно вступает в реакцию: Zn+СuSО4 == Сu + ZnSO4. Если эту реакцию проводить не путем простого контакта цинка с раствором СuSО4, а электрохимическим способом /в гальваническом элементе/, то химическая энергия, выделяющаяся в результате реакции, превращается в электрическую энергию, за счет которой может быть совершена работа. В противоположном направлении (Сu + ZnSO4 == == CuSO4 + Zn) эта реакция самопроизвольно протекать не может, её можно осуществить только при затрате работы извне. Говорят, что Znи СuSО4 обладают химическим сродством друг к другу, а Сu и ZnSO4- не обладают В общем случае, если вещества А и В способны к самопроизвольному /без затраты работы извне/ взаимодействию, они обладают химическим сродством друг к другу.
Решение вопроса о химическом сродстве, т.е. о возможности самопроизвольного протекания данной реакции в данном направлении, установление количественного критерия принципиальной осуществимости того или иного процесса является второй из обсуждаемых здесь задач химической термодинамики.
Большинство химических реакций завершается установлением состояния химического равновесия, которое, с точки зрения химической кинетики /уш ния о скоростях реакций/, характеризуется равенством скоростей прямой и обратной реакций и неизменностью во времени концентраций участвующих в реакции веществ. Состояние равновесия для различных реакций устанавливается при различном соотношении концентраций исходных веществ и продук тов реакции, т.е. при различной полноте превращения одних веществ в дру гие. Полнота превращения исходных веществ в продукты реакции зависит от условий установления равновесия и характеризуется константой равновесия
|
|
|
Методы химической термодинамики позволяют рассчитывать константы химических равновесий для различных процессов и устанавливают зависимость константы равновесия от различных факторов. Это третья из рассматриваемых в этой лекции задач химической термодинамики.
Итак, в кратком изложении.обсуждаемые нами задачи химической термодинамики сводятся к следующему:
I.Определение тепловых эффектов химических процессов.
2.Выяснение критерия возможности самопроизвольного протекания данной химической реакции в данном направлении.
3.Установление степени превращения исходных веществ в продукты реакции, т.е. соотношение их концентраций при достижении состояния химического равновесия.Химическая термодинамика является приложением.общей термодинамики к химическим процессам. Мы не обсуждаем здесь предмет и задачи термодинамики в целом, т.к. это обсуждение проводится в курсе физики.
Аппарат химической термодинамики в той или иной степени применим к исследованию химических процессов, протекающих в живых организмах, поэтому химическая термодинамика является теоретической основой биоэнергетики. Знание основных законов термодинамики позволяет будущему врачу получить ясные представления об энергетическом балансе человеческого организма, установить калорийность потребляемой человеком пищи, выяснить особенности преобразования одних видов энергии в другие в процессе жив-недеятельности, получить в свои руки объективные критерии, с помощью которых можно судить об осуществимости тех или иных реакций в человеческом организме.
2.ОСНОВНЫЕ ПОНЯТИЯ И ВЕЛИЧИНЫ.
Познакомимся с некоторыми основными понятиями и величинами, используемыми в химической термодинамике.
Система - рассматриваемое вещество /тело/ или совокупность находящихся между собой во взаимодействии веществ /тел/, которые фактически или мысленно выделяютя из окружающей среды. Таким образом, можно записать такое равенство: Вселенная == Рассматриваемая система + Окружающая среда.
|
|
|
Системы бывают физическими, в которых отсутствует химическое взаимодействие между компонентами/например, смесь инертных газов в каком-либо сосуде/ и химическими, в которых имеет место химическое взаимодействие между компонентами /например, сосуд, в котором протекает реакция: СбН12°б + 6 02 == б С02 + б Н20/.
Фаза - совокупность однородных частей системы, имеющая одинаковый состав во всем объеме, одинаковые физические и химические свойства и отделенная от других частей системы поверхностью раздела, при переходе через которую некоторые свойства системы изменяются скачкообразно.
В зависимости от числа фаз, составляющих систему, все системы делятся на гомогенные и гетерогенные.
Гомогенная /однородная/ система - это система, состоящая из одной фазы. Например, некоторый объем кислорода - это гомогенная однокомпонен-тная физическая система; система химической реакции с участием только газообразных веществ 2 СО + О2 == 2 СО2 - это гомогенная.трехкомпонентная химическая система. Истинные растворы и системы химических реакций с участием истинных растворов также являются примерами гомогенных систем.
Гетерогенная система - это система, состоящая из двух и более фаз. Примером гетерогенной системы может служить система "твердая соль - насыщенный водный раствор соли - насыщенный водяной пар" или система химической реакции:2А1/тв./ + б HCI == 2 А1С13/р-р/ + 3 Н^/г/.
По характеру взаимодействия с окружающей средой системы делятся на изолированные, закрытые и открытые.
Изолированной называется система, которая не обменивается с окружающей средой ни массой /веществом/, ни энергией.
Закрытая система - это такая система, которая обменивается с окружающей средой энергией, но не обменивается массой.
Открытая система обменивается с окружающей средой и массой и энергией. Важнейшим примером открытых систем являются живые организмы, для которых непрерывный материальный и энергетический обмен с окружающей средой мига представляет собой необходимое условие их существования.
|
|
|
Совокупность ряда экспериментально определяемых физических и химических свойств системы /например, температура, давление, масса, плотность, объем, концентрация, химический состав фаз, входящих в систему, и др./ определяют состояние системы. Указанные величины, определяющие состояние системы, называются термодинамическими параметрами.
Изменение величины хотя бы одного термодинамического параметра приводит к изменению состояния системы. Всякое изменение в системе, связанное с изменением одного или нескольких параметров, называется термодинамическим процессом.
На практике мы часто встречаемся с такими термодинамическими процессами, в ходе которых один или несколько параметров сохраняют постоянное значение. Наиболее важными из них являются следующие процессы:
а) изотермические прцессы - совершаются при постоянной температуре Т;
б) изобарические процессы - совершаются при постоянном давлении Р;
в) изохорические процессы - совершаются при постоянном объеме V;
г) изобарно-изотермические процессы - совершаются в условиях постоянства и давления, и температуры;
д) изохорно-изотермические процессы - совершаются в условиях постоянства и объема, и температуры.
Химические реакции часто протекают при атмосферном давлении и при —^ комнатной температуре, т.е. в изобарно-изотермическом режиме. Этот режим вообще имеет место в том случае, когда взаимодействие между веществами осуществляется в открытых сосудах без нагревания или охлаждения реакционной смеси в ходе реакции за счет внешнего источника. Изобарно-изотермические условия характерны и для реакций в живых организмах.
Если химические реакции протекают в закрытых сосудах при постоянной температуре, то имеет место изохорно-изотермический режим.
Любая система характеризуется также рядом величин, которые не могут быть экспериментально определены, но которые непосредственно зависят от
состояния (и только от состояния!) системы и поэтому называются функциями состояния. Важнейшими функциями состояния являются внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G• Изменение любой функции состояния* X в каком-нибудь процессе /4Х/ зависит только от начального и конечного состояния системы и не зависит от пути перехода, т.е. ^X=Xg-Xj, где Xj - значение данной функции состояния в начале процесса и Х£ - значение ее в конце процесса.
В курсе физики вы уже встречались с понятием "внутренняя энергия системы". Вспомним, что характеризует эта функция состояния системы.
/U другими функциями состояния мы будем знакомиться в ходе последующего изложения темы/.
Внутренняя энергия характеризует общий запас энергии системы, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергию движения электронов в атомах, энергию, заключающуюся в ядрах атомов, энергии связей атомов в молекулах и другие виды энергии, кроме кинетической энергии тела в целом и его потен циальной энергии положения в поле тяготения. В настоящее время еще нет способов определения абсолютной величины внутренней энергии какой-либо системы, но имеется возможность определить изменение внутренней энергии A U., происходящее в том или ином процессе при переходе системы из одного состояния /с энергией tlf/ ъ другое состояние /с энергией tiz /•
ли = г/2 - Ui
Оказывается достаточным знать AU для успешного применения данной функции состояния в термодинамике.
Внутренняя энергия зависит, очевидно, как от вида и количества рассматриваемого вещества, так и от условий его существования.
Если говорить о химических реакциях, то суммарная внутренняя энергия продуктов реакции в общем случае отличается от суммарной внутренней энергии исходных веществ, т.к. в процессе реакции происходит перестройка электронных оболочек атомов взаимодействующих молекул.
Энергия может передаваться от одной системы к другой или от одной части системы к другой ее части в форме теплоты иди в форме работы.
Теплота - форма передачи энергии путем хаотического, неупорядоченного движения частиц. /Обозначается буквой (2 /.
Работа - форма передачи энергии путем упорядоченного перемещения частиц под действием каких-либо сил. /Обозначается буквой А /.
Ни GL, ни А в общем случае не являются функциями состояния,т.е.ко-личество теплоты,выделяемой или поглощаемой системой,и количество работы, совершаемой системой или над системой,зависит не только от начального и б.
конечного состояния системы, но и от того, как происходил переход от одного состояния к другому.
3.Т ЕПЛОВ ЫЕ гФФЕКТИ ХИ МИЧЕСК ИХ И БИОХИМИЧЕСКИХ ДИЩШШЦМ ПРОЦЕССОВ.
Расчеты тепловых эффектов различных процессов могут быть осуществлены с помощью первого закона /начала./ термодинамики, который является частным случаем закона сохранения энергии.применительно к процессам, связанным с переходом энергии в системах в форме теплоты и работы.
Первый закон термодинамики является постулатом; он не может быть по существу доказан логическим путем, а вытекает из суммы всего человеческого опыта. Справедливость этого закона доказывается тем, что ни одно из следствий, к которым он приводит, не находится в противоречии с опытом.
В установлении современной формы выражения первого закона термодинамики большую роль сыграли работы Г.И.Гесса /1840/, Р.Майера /1842/, Джоуля /1847/, Гельмгольца/1847/ и др. Кстати, и русский ученый Герман Иванович Гесс, и немецкий исследователь Роберт Майер по образованию были медиками.
Можно дать несколько формулировок первого закона, которые по существу равноценны одна другой. Большое значение имеет следующая формулировка первого закона термодинамики.
Изменение внутренней энергии системы при переходе ее из одного состояния /I/ в другое /2/ равно теплоте полученной системой извне, за вычетом работы /А/, совершенной системой:
/I/
Это соотношение следует рассматривать как математическое выражение I закона термодинамики. Все величины в этом выражении, разумеется, должны быть выражены в одинаковых единицах измерения. Теплоте, выделяемой системой, и теплоте, поглощаемой ею, всегда приписывают противоположные знаки. В термодинамике принято считать положительной теплоту 4? > поглощаемую системой в данном процессе, и отрицательной - теплоту, выделяемую системой. Работа А считается положительной, если она совершается системой над окружающей средой; если же работа совершается над системой, ей приписывают отрицательный знак.
Выражение /I/ можно преобразовать и представить его.в таком виде:
/г/
Это выражение означает, что если к системе подводится теплота, то в общем случае она расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил.
В ходе химических реакций, протекающих в открытых сосудах, и биохимических процессов в живых организмах весьма часто происходит изменение объема вследствие выделения газообразных веществ. Поэтому неизбежно со- 


















27.
тываем влияния температуры на величины дН и А$>. Тем не менее, полученные данные позволяют сделать правильные выводы о том, что рассматриваемая реакция при стандартной температуре не может самопроизвольно протекать в указанном нап$влении /iMrgggX)/ и, следовательно, при этой температуре возможно самопроизвольное протекание реакции в обратной направлении /образование СаСОз из СаО и COg/, а при Т=1560°К реакция в указанном направлении протекает самопроизвольно /aG^qqKO/.
Если концентрации реагирующих веществ отличаются от стандартных, то энергия Гиббса реакции также шш не равна стандартной энергии Гиббса. Однако, при этом следует иметь в виду, что при резко выраженных отрицательных значениях ДСгппа химической реакции взаимодействие протекает самопроизвольно практически при любых концентрациях веществ. И наоборот, если д#Ядо»0, то7 самопроизвольное течение процесса неосуществимо и при концентрациях, отличных от стандартных.
В тех же случаях, когда величины Л Ј§gg для реакций невелики по абсолютной величине., изменение концентраций участвующих в реакции веществ может изменить даже знак A^t- по сравнению с A^ggg» и поэтому в этих случаях судить о направлении реакции по величинам стандартных энергий Гиббса можно только тогда, когда концентрации близки к стандартным.
В заключение этого раздела необходимо отметить, что. отрицательное значение энергии Гиббса химичекой реакции указывает только на принципиальную возможность ее протекания. В действительности, реакция при этом нередко и не наблюдается. Это связано с тем,что величина Aug ^совершенно не зависит от механизма химической реакции, которым определяется скорость реакции /изучением механизмов и скоростей химических реакций занимается другой раздел химии - химическая кинетика/. Механизмы многих реакций таковы, что скорости этих реакций при обычных условиях шишшшшвюшпшшш Шицгг" ..... практически равны нулю, ж реакции не протекают, несмотря на отрицательное значение 4<?у Например, процессы окисления глюкозы и многих других органических веществ кислородом воздуха характеризуются отрицательными значениями энергии Гиббса, однако эти вещества сохраняются на воздухе в течение длительного времени без всяких признаков изменений.
В этом проявляется ограниченность термодинамики, которая позволяет нам лишь получать сведения о возможности протекания данной реакции в данном направлении, но ничего не утверждает относительно скорости реакции. Чтобы какая-нибудь реакция началась, сначала надо тем или иным способом снабдить молекулы реагентов некоторой избыточной энергией, чтобы они могли преодолеть энергетический барьер, или попытаться снизить этот барьер путем введения катализаторов. Все это является предметом изучения химической кинетики.







35.
азота, кислорода, серы и т.д. так же хорош, как любой другой eitom того же элемента. Что же достигается их обменом, что составляет то драгоценное нечто, содержащееся в нашей пище и предохраняющее нас от смерти /равновесия/? На это легко ответить. Каждый процесс, явление, событие, короче говоря, все, что происходит в Природе, означает увеличение энтропии в той части Вселенной, где это имеет место. Так и живой организм непрерывно увеличивает свою энтропию, или, иначе, производит - положительную энтропию и, таким образом, приближается к опасному состоянию максимальной энтропии, представляющему собой смерть. Он может избежать этого состояния, т.е. оставаться живым, только постоянно извлекая из окружающей среды "отрицательную" энтропию. Отрицательная энтропия - это то, чем организм питается. В самом деле, организм усваивает высокоупо-рядоченные продукты, обладающие малой энтропией /белки, жиры, углеводы и другие высокомолекулярные соединения/. Выделяет же организм в окружающую среду продукты распада и окисления высокомолекулярных соединений /воду, углекислый газ, мочевину и др./, т.е. низкомолекулярные вещества, обладающие в совокупности значительно большей энтропией, чем суммарная энтропия поступивших в организм высокомолекулярных соединений.
Таким образом, существенно в метаболизме то, что организму удается освобождаться от всей той энтропии, которую он производит, пока жив. В результате, организм поддерживает себя на постоянном и достаточно низком уровне энтропии.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Т.М.Х.Карапетьянц. Введение в теорию химических процессов, М.,"Высшая школа", 1975.
2.С.А.Балезин, Ь.В.Ерофеев, Н.И.Подобаев. Основы физической и коллоидной химии, М./'Просвещение", 1975.
3.В.В.Кузнецов, В.Ф.Усть-Качкинцев. Физическая и коллоидная химия, М., "Высшая школа", 1976.
4.Р.4анг. Физическая химия с приложениями к биологическим системам, М., "Мир", 1980.
5.Э.Шредингер. Что такое жизнь /с точки зрения физика/, М.,"Атомиздат", 1972.
6.К.А.Макаров. Химия и медицина, М.,"Просвещение", 1981.
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1826; Нарушение авторских прав?; Мы поможем в написании вашей работы!