
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические сведения 1 страница
|
|
|
|
Неметаллы занимают верхнюю правую часть ПС. Характерной особенностью их является то, что застройка наружных электронных оболочек близка к максимальной. Чем правее расположен неметалл, тем выше ЭИ, тем выше энергия сродства к электрону. Неметаллы проявляют тенденцию к формированию электронных оболочек с конфигурацией благородного газа, поэтому возрастает слева, направо способность к присоединению электрона. Внутри групп эти закономерности проявляются снизу вверх, поэтому наиболее электроотрицательным является фтор.
Высшая степень окисления неметаллов всегда соответствует номеру группы. Семь неметаллов существуют в виде двухатомных молекул. Пять из них - газы (кислород, азот, водород, фтор, хлор), бром – жидкость, йод – кристаллическое вещество, способное возгоняться не плавясь. Остальные – одноатомные кристаллы с различной структурой или газы.
Большинство неметаллов встречается в природе в виде соединений с другими элементами. Только кислород, азот, углерод, сера и благородные газы встречаются в виде простых веществ.
Не имеют характерного для металлов блеска, в кристаллическом состоянии отличаются структурой и прочностью кристаллов, плохо проводят тепло и электрический ток. Оксиды неметаллов – ковалентные соединения, по химическим свойствам относятся к кислотным. Химически активны. Реакционная способность варьирует в широких пределах. Получают неметаллы в большинстве случаев с помощью ОВР.
Элементы главной подгруппы III группы ПС - бор, алюминий, а также галлий, индий, таллий относятся к р-элементам. Электронная конфигурация наружного слоя атомов: … ns2np1.
В нормальном состоянии атомы содержат один неспаренный з-электрон, однако, соединения, в которых эти элементы проявляют степень окисления +1, мало характерны. Их устойчивость возластает от Al к Tl. Характерная степень окисления +3 и валентность III отвечает возбужденному состоянию атомов, то есть переходу одого из s-электронов внешнего слоя на р-орбиталь:
|
|
|
2 s 2 р 2 s 2 р
| В | ¯ | | В* | | | |
Вследствие sp2-гибритизации образуется три гибридные орбитали, лежащие в одной плоскости под углом 120 0. Этим объясняется плоскостное строение мономеров галогенидов, например BF3.
Свойства бора и алюминия, расположенных в одной группе, существенно различаются: бор – неметалл, алюминий – металл. Это объясняется меньшим радиусом атома бора и меньшим числом электронов, экранирующих притяжение внешних электронов ядром (В – zs2; Al – zs22s2p6). Поэтому ионизационные потенциалы бора больше, а восстановительная активность слабее, чем у алюминия.
Вследствие большого заряда ядра и близости валентных электронов к ядру, химические связи, образуемые бором, имеют ковалентный характер. В соединениях алюминия больше степень ионизации. Например, AlCl3 по свойства близок к солям, BCl3 – галогенангидрид. Водные растворы солей алюминия (AlCl3, Al2(SO4)3, Al(NO3)3 и др.) содержат гидратированные ионы Al3+, бор иона В3+ не образует,для него характерны анионные комплексы: ВО2- и ВО3-.
Р-элементам III группы характерны оксиды типа: Э2О3. По химическим свойствам В2О3 – кислотный оксид. Ему соответствует слабая борная кислота – Н3ВО3. Гидроксиды Al(OH)3, Ga(OH)3, In(OH)3 (как и оксиды алюминия, галлия, индия) амфотерны, а Tl(ОН)3 обладает основными свойствами. При растворении гидроксидов и оксидов алюминия в кислотах образуются аквакомплексы, а в щелочах - гидроксокомплексы:
Al(OH)3 + 3H3O+ = [Al(H2O)6]3+
Al(OH)3 + 3OH- = [Al(OH)6]3-
Атом бора и алюминия в трехвалентном состоянии имеют одну свободную р-орбиталь и могут быть акцепторами электронов, образуя четвертую ковалентную связь по донорно-акцепторному механизму. В комплексных соединениях координационное число бора равно 4, у алюминия – 4 и 6. Увеличение числа донорно0акцепторных связей до шести у алюминия, в отличие от бора, возможно вследствие наличия свободных d-орбиталей в наружном слое и sp3d2 – гибритизации. Наличием свободных орбиталей в наружном электронном слое объясняется склонность соединений бора и алюминия к реакциям присоединения и полимиризации.
|
|
|
Бор – неметалл, имеет несколько аллотропных модификаций, СО +3, +1, -1, -3, в природе встречается в виде борной кислоты (Н3ВО3), буры (Na2В4О7·10Н2О). В свободном состоянии представляет собой темно-бурый порошок.
Аморфный бор получают магнийтермическим восстановлением оксида бора (при температуре 2000 0С):
В2О3 + 3Mg → 3MgO + 2B
Бор высокой чистоты получают термическим разложением водородных соединений или галогенидов бора:
H6B2 → 2B + 3H2
2BF3 → 2B + 3F2
Кристаллический бор обладает полупроводниковыми свойствами. По химическим свойствам он похож на кремний (диагональное сходство). В большинстве соединений бор проявляет степень окисления +3, в соединениях с металлами и водородом - -3.
Бор обладает прочной кристаллической решеткой, поэтому при обычных температурах он инертен. Взаимодействует только с фтором:
2В + 3F2 = 2BF3
При нагревании бор образует соединения с серой, азотом. С углеродом образует карбиды – тугоплавкие и химически устойчивые соединения. По твердости они приближаются к алмазу:
В + С = СВ2
Бор устойчив по отношению к воде, однако при температуре красного каления взаимодействует с водяным паром, вытесняя из него водород:
2В + 3Н2О = В2О3 + 3Н2↑
Бор окислятся концентрированной азотной и серной кислотами до борной кислоты:
В + 3HNO3 = H3BO3 + 3NO2
Амфотерный мелкораздробленный бор растворяется в концентрированных растворах щелочей:
2B + 2NaOH + H2O = 2NaBO2 + 3H2
С металлами бор образует бориды. Бориды d- и f-элементов очень тверды, жаростойки, химически устойчивы. Бориды s-элементов химически активны, разлагаются кислотами с образованием гидридов бора:
6MgB2 + 12HCl = H2 + B4H10 + 6MgCl2 + 8B
Непосредственно с водородом бор не реагирует. Соединения бора с водородом (гидриды бора, бораны) получают косвенным путем. Бораны имеют состав: BnHn+4. Моноборан ВН3 не получен. Эта молекула неустойчива (∆G = 109 кДж/моль). Взаимодействуя друг с другом, они образуют димер с прочными трехцентровыми связями типа В…Н…В:
|
|
|
2ВН3(г) = В2Н6(г) ∆G = -126 кДж/моль
Бораны (ди- и тетра-) – водородные соединения бора получают реакцией разложения при действии соляной кислоты на борид магния и реакцией гидрида лития с трифторидом бора:
Mg3B2 + HCl = MgCl2 + B2H6 (B4H10)
6LiH + 8BF3 = 6Li[BF4] + B2H6
Бораны – газы или легко летучие жидкости с неприятным запахом, ядовиты, по свойствам напоминают силаны: неустойчивы, легко самовоспламеняются на воздухе, являются восстановителями, разлагаются водой, спиртами и щелочами с выделением водорода:
B2H6 + 6H2O = 6H2 + 2H3BO3
При сгорании боранов выделяется большое количество тепла:
В2Н6 + 3О2 = В2О3 + 3Н2О; ∆Н = -2025 кДж/моль
Диборан с гидридом лития в среде эфира образует тетрагидридоборан лития:
В2Н6 + 2LiH = 2Li[BH4]
Известны устойчивые ионные гидридобораты щелочноземельных металлов (Li[BH4], Na[BH4], K[BH4], Mg[BH4]2) и ковалентные реакционноспособные тетрагидридобораты типа: Al(BH4)3. Гидробораты широко используются как восстановители в синтезе органических соедениней. Например, Na[BH4] восстанавливает альдегиды и кетоны до соответствующих спиртов.
С галогенидами при нагревании бор образует соединения с общей формулой: ВГ3. Молекулы типа ВГ3 имеют форму плоского треугольника с атомом бора в центре. Галогениды бора разлагаются водой, образуядве кислоты:
ВГ3 + 3Н2О = Н3ВО3 + 3НГ
Вещества, реагирующие с водой с образованием двух кислот, одна из которых галогеноводородная, называются галогенангидридами. Следовательно, ВГ3 – галогенангидриды борной кислоты.
Фторид бора, образующий с фторид-ионом прочный комплексный ион [BF4]-, реагирует с водй иначе:
BF3 + 3H2O = H3BO3 + 3HF
3HF + 3BF3 = 3H[BF4]
----------------------------------------------------------------------
4BF3 + 3H2O = H3BO3 + 3H[BF4]
Галогениды бора, аналогично гидридам, оксидам и другим бинарным соединениям бора (III), являются соединениями с дефицитом электронов. Они проявляют свойства кислот Льюиса, выступая акцепторами электронных пар в реакциях присоединения. Например, при пропускании BF3 через водный раствор HF образуется комплексная тетрафторборная или борфтористоводородная кислота H[BF4]:
|
|
|
HF + BF3 = H[BF4], ∆G = -67 кДж
Эта кислота устойчива только в растворе, ее кислотные свойства выражены сильнее, чем у HF. Соли – тетрафторобораты или просто фторобораты, изоморфны перхлоратам, в большинстве они хорошо растворимы в воде. К малорастворимым относятся: K[BF4], Rb[BF4], Cs[BF4].
При температуре (100 0 С) бор взаимодействует непосредственно с кислородом, образуя кислотный оксид – борный ангидрид – бесцветная стекловидная масса, растворимая в воде:
4В + 2О2 = 2В2О3
Оксид бора также можно получить прокаливанием ортоборной кислоты:
2Н3ВО3 = 3Н2О + В2О3
Борный ангидрид очень гидроскопичен, с водой образует борную кислоту:
В2О3 + 3Н2О = 2Н3ВО3
Оксиду бора отвечает ряд полимерных кислот общей формулой nВ2О3·mН2О. Соли борных кислот – бораты (оксобораты). В воде растворимы только бораты наиболее активных одновалентных металлов. Оксид и кислорождосодержащие кислоты бора и их производные содержат в своей структуре неупорядоченно расположенные плоско-треугольные фрагменты, образующие гетероатомные полимеры (рис. 4).
Борная кислота – это белые чешуйчатые кристаллы, плохо растворимые в холодной воде и хорошо в горячей. Это слабая одноосновная кислота (Ка=5,8·10-10):
Н3ВО3 + Н2О = [В(ОН)4]- + Н+
При нагревании борная кислота переходит в метаборную НВО2, имеющую полимерную модификацию (НВО2)n с циклической структурой, а затем в тетраборную Н2В4О7 и борный ангидрид В2О3. При их взаимодействии с водой всегда получается борная кислота.
Из солей наиболее распространены тетрабораты – соли более сильной тетраборной кислоты (Ка=1,8·10-4). Они образуются при нейтрализации раствора ортоборной кислоты щелочами:
4Н3ВО3 + 2NaOH = Na2B4O7 + 7H2O
Возможно, что в растворе образуются также соли орто- и метаборных кислот, но растворимость тетрабората наименьшая.
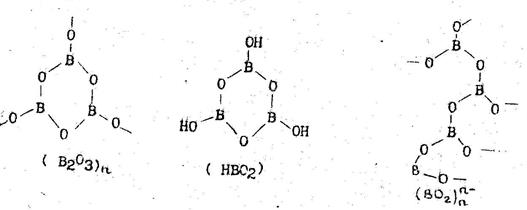
Рис. 4. Гетероатомные полимеры бора.
Из водного раствора тетраборат натрия выделяется в виде декагидрата: Na2B4O7·10Н2О – буры.
Метабораты могут быть получены действием избытка щелочей на тетрабораты или при сплавлении оксидов металлов с бурой:
Na2B4O7 + 2NaOH = 4NaBO2 + H2O
Na2B4O7 + CuO = Na2Cu(BO2)4
Образование ортоборатов нехарактерно.
Все боные кислотв – слабые, поэтому водные растворы их солей подвергается гидролизу по аниону (рН>7):
ВО2- + Н2О = НВО2 + ОН-
Из водных растворов боратов действием сильных кислот вытесняется Н3ВО3, а при высоких температурах борная кислота вытесняет большинство других кислот из их солей. Если в метаборной кислоте заместить атом кислорода на пероксидную группу (-О-О-), то получится надборная кислота. Ее соли – пербораты (NaBO2·H2O2·3H2O) являются сильными окислителями и используются при производстве моющих средств.
Борная кислота и бораты образуют устойчивые комплексы анионного типа с полиоксисоединениями, например с глицерином:






 СН2-ОН СН2О ОН2С -
СН2-ОН СН2О ОН2С -



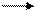
 2 СН –ОН + Н3ВО3 = Н+ СНО В ОН-С + 3Н2О
2 СН –ОН + Н3ВО3 = Н+ СНО В ОН-С + 3Н2О
СН2-ОН СН2ОН НО-Н2С
Образовавшаяся глицероборная кислота представляет собой сильную кислоту и может быть оттитрована раствором щелочи при количественном определении борной кислоты. Аналогичные процессы протекают при расстворении в глицерине тетрабората натрия.
Качественной реакцией на борную кислоту и бораты является образование борноэтилового или борнометилового эфира при нагревании с этанолом или метанолом в присутствии концентрированной серной кислоты:
Н3ВО3 + 3С2Н5ОН = В(ОС2Н5)3 + 3Н2О
Полученный эфир горит, окрашивая пламя в ярко-зеленый цвет:
2В(ОС2Н5)3 + 18О2 = В2О5 + 12СО2 + 15Н2О
Применяют бор в металлургии для лигировния сплавов, дубления кож, производстве эмалей и красок, в консервном производстве.
Элементы бор и алюминий играют важную биологическую роль. Бор является важным микроэлементом, необходимым раствениям. Борная кислота и бура в медицине применяется как антисептик. Их использование основано на бактериостатическом и антисептическом действии:
Na2B4O7 + H2SO4 + 5H2O = 4Н3ВО3 + Na2SO4
Алюминий самый распространенный металл в природе, на его долю приходится 7,45% от веса земной коры. Входит в состав глины и многих минералов: боксит (Al2O3·nH2O) – исходное сырье для получения алюминия путем электролиза. Это серебристо-белый легкий металл, ковкий, плавится при 660 0С, температура кипения 23270С, тягуч, пластичен, с хорошей электро и теплопроводностью. Сильный восстановитель (Е0 = -1,668 В). На воздухе устойчив, так как покрывается оксидной пленкой (Al2O3), которая предохраняет от коррозии. Если нарушить этот слой, алюминий быстро окисляется. Прочность и устойчивость оксидной пленки сильно снижается при контакте алюминия с металлической ртутью, магнием, натрием, медью. Чтобы повысить коррозионную устойчивость алюминия, его поверхность пассивируют действием K2Cr2O7, концентрированной азотной кислотой или анодным окислением (при этом увеличивается толщина оксидной пленки).
Для алюминия характрены степени окисления +1, +3 иреакции присоединения, полимеризации (также как и у бора).
При комнатной температуре алюминий реагирует с хлором и бромом, в присутствии катализатора (Н2О) – с йодом:
2Al + 3Cl2 = 2AlCl3
2Al + 3Br2 = 2AlBr3
2Al + 3I2 = 2AlI3
При нагревании с серой, азотом и углеродом:
2Al + 3S = Al2S3
Al + N2 = AlN2
Al + C = AlC
Соединения алюминия с водородом получают косвенным путем.
Алюминий обладает очень большим сродством к кислороду, поэтому при взаимодействии его с ним выделяется большое количество теплоты:
4Аl + 3O2 = 2Al2O3 +3285 кДж (∆G = -1582 кДж/моль)
Это свойство используют в алюмотермии для восстановления многих металлов из их оксидов порошковым алюминием:
Cr2O3 + 2Al = Al2O3 + 2Cr
Чистый алюминий устойчив к действию воды и растворов кислот, но обычный – технический – легко растворяется (особенно при нагревании) в соляной, медленнее азотной и серной кислотах средней концентрации:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Сильно разбавленная серная кислота, а также уксусная и фосфорная, не действуют на алюминий.
Концентрированные кислоты (азотная, серная), дихромат калия на холоду пассивируют металл. После погружения алюминия в концентрированную азотную кислоту он не растворяется даже в соляной кислоте.
Реакция растворения алюминия, его оксида и гидроксида в кислоте проходят по схемам:
2Al + 6H+ +12H2O = 2[Al(H2O)6]3+ + 3H2
Al2O3 + 6H+ + 9H2O = 2[Al(H2O)6]3+
[Al(OH)3(H2O)3] + 3H+ = [Al(H2O)6]3+
Алюминий хорошо растворяется в щелочах с образованием комплексных солей – алюминатов, это объясняется растворением в щелочи защитной оксидной пленки. Реакции растворения алюминия, его оксида и гидроксида в щелочи идут по схемам:
- при недостатке щелочи
2Al + 2NaOH + 10H2O = 2Na[Al(OH)4(H2O)2] + 3H2
Al2O3 + 2NaOH + 7H2O = 2Na[Al(OH)4(H2O)2]
[Al(OH)3(H2O)3] + NaOH = 2Na[Al(OH)4(H2O)2] + H2O
- при избытке щелочи
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]
[Al(OH)3(H2O)3] + 3NaOH = 2Na3[Al(OH)6] + 3Н2О
В способности растворятся в кислотах и щелочах проявляются амфотерные свойства алюминия, его оксида и гидроксида.
Оксид алюминия Al2O3 - амфотерный оксид, белое, очень тугоплавкое и твердое. Известны три модификации: α, β, γ. α-форма называется корундом или наждак – абразивный материал. β-форма глинозем. Рубин – темно-красный драгоценный металл – Al2O3·Cr2O3.
Образование донорно-акцепторных связей за счет d-орбиталей атома алюминия и неподеленных электронных пар атома кислорода обуславливает прочность кристаллической решетки и объясняет его химическую стойкость, твердость, обилие природных соединений, содержащих связи –Al-O-Al-. При комнатной температуре Al2O3 не взаимодействует с водой, кислотами и щелочами.
Гидроксид алюминия Al(ОН)3 получают косвенным путем – осаждением щелочами, аммиаком, сульфидом аммония или карбонатами щелочных металлов:
Al2(SO4)3 + 6NaOH = Al(ОН)3 + 3Na2SO4
Свежеприготовленный гидроксид алюминия содержит большое количество химически связанной воды. Точнее ее состав отражает формула Al(ОН)3·nН2О. Он является полимерным соединением, поэтому хороший адсорбент. При высушивании получается продукт состава: AlO(OH) или Al2O3·H2O. Он амфотерен, растворяется в кислотах и щелочах, но не растворяется в аммиаке (в отличае от гидроксидов многих d-элементов):
Al(OH)3↓ + 3OH- ↔ [Al(OH)6]3-
Al(OH)3↓ + 3H+↔ [Al(H2O)6]3+
Соли алюминия, получаемые сплавлением оксида алюминия со щелочами называют алюминатами:
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Их можно рассматривать как производные метаалюминиевой кислоты HAlO2. В них алюминий входит в состав аниона. Алюминаты щелочных металлов хорошо растворимы в воде. Водные растворы алюминатов содержат ионы: [Al(OH)4(Н2О)2]- и [Al(OH)6]3-. Алюминаты, как соли слабой кислоты, в водном растворе подвергаются гидролизу по аниону и имеют щелочную реакцию среды (рН<7). Они устойчивы к сильнощелочной среде.
Соли алюминия, образованные сильными кислотами, вследствие обратимого гидролиза показывают в водном растворе кислую реакцию среды:
Al2(SO4)3 + 2HOH ↔ 2AlOHSO4 + H2SO4
Al3+ + HOH ↔ AlOH2+ + H+
[Al(H2O)6]3+ + HOH ↔ [Al(H2O)5OH]2+
Затем образуются полиядерные комплексы: [Al2(OH)2]4+.
Соли слабых кислот – карбонаты, сульфиды, в водных растворах подвергаются необратимому гидролизу:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Поэтому эти соли нельзя получить реакцией обмена в водном растворе вследствие полного их гидролиза:
Al2(SO4)3 + 3Na2S + 6HOH = 2Al(OH)3↓ + 3H2S↑+ 3Na2SO4
Безводные галогениды (кроме AlF3) хорошо растворимы, легкоплавки и летучи, «дымят» на воздухе, в воде растворяются с выделением теплоты. AlF3 с фторидами щелочных металлов образует фтороалюминаты, из которых наиболее важен Na3[AlF6].
Для катиона Al3+, имеющего малый радиус и большой заряд, характерны реакции комплексообразования. В комплексных соединениях координационное число равно 4 и 6 (вследствие наличия свободных орбиталей в наружном слое и sp3d2-гибритизации). Склонность к комплексообразованию больше, чем у магния, но меньше, чем у бора. Al3+, аналогично другим s- и р-элементам, образует комплексные соединения с водой, гидроксид-ионами, фторид-ионами, менее устойчивы комплексы с Cl-, Br-, I-. Не образует прочных комплексов с CN-, NH3 и другими лигандами, образующими прочные комплексы с d-элементами.
Для алюминия известно большое количество кристаллогидратов и кристаллосольватов, содержащих катионные, октаэдрические комплексы [Al(H2O)6]3+, но возможно образование и анионных комплексов: [AlF6]3-, [AlH4]-.
Ион Al3+ обладает сильным коагулирующим действием, легко и прочно соединяется с белками, поэтому наряду с тяжелыми металлами может захватываться клеткой и задерживаться в ней в течении жизни.
Из водных растворов многие соли алюминия выделяются в виде кристаллогидратов, например: AlF3·6H2O, Al2(SO4)3·18H2O. Безводные AlCl3, AlBr3, AlI3 нельзя получить удалением воды из кристаллогидратов, так как при нагревании происходит гидролиз:
AlCl3·6H2O → Al(OH)3↓ + 3H2O↑ + 3HCl↑
Сульфат алюминия с сульфатами одновалентных металлов (K+, Na+, NH4+) образует двойные соли, называемые квасцами. Квасцы – изоморфные двойные соли сульфатов хорошо растворимые в воде, негигроскопичны, из воды кристаллизуются в виде октаэдрических кристаллов. Общая формула квасцов: МIMIII(SO4)2·12H2O, где МI – катионы K+, Na+, NH4+, Rb+, Cs+, Te+; MIII – катионы Al3+, Fe3+, Cr3+, Ga3+ и др. Кристаллическая решетка их содержит ионы [M+(H2O)6]+, [M3+(H2O)6]3+, SO42-.
Алюминий применяется в авиационной и автомобильной промышленности в виде легких сплавов. Для получения других металлов (алюмотермический метод). Изготавливают электрические провода, посуду, предметы домашнего обихода.
Рубин применяют в точном приборостроении и часовой промышленности.
Гидроксид алюминия используется в медицине как адсорбент, обволакивающее средство: наружно – для присыпок, внутрь при лечении гастритов, язв, т.к. обладает антацидным действием (альмагель, ацетат алюминия).
Алюмокалиевые квасцы KAl(SO4)2·12H2O применяют в качестве прижигающего и кровеостанавливающего средства. 10% раствор используют для полосканий.
Подгруппа галлия (галлий, индий и таллий) характеризуются одинаковым строением последнего и предпоследнего квантовых слоев: (n-1) s2p6d10 n s2p1
Мало распространены в природе: галлия – 10-4%, индия и таллия – по 10-5%. Это серебристо-белые, мягкие, легкоплавкие металлы.
На воздухе галлий и индий не меняются, а таллий покрывается оксидной пленкой:
4Tl + 3O2 = 2Tl2O3
Растворяются в кислотах:
2Tl + 6HCl = 2TlCl3 + 3H2.
Галлий и индий взаимодействуют со щелочами:
2Ga + 6NaOH + 6H2O = 2Na3[Ga(OH)6] + 3H2
При обычной температуре взаимодействуют с хлором и бромом, а при нагревании – с кислородом, серой и йодом.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 769; Нарушение авторских прав?; Мы поможем в написании вашей работы!