
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Индукционный эффект
|
|
|
|
Электронные смещения в молекулах органических веществ.
Установлены два механизма электронных смещений, при которых сохраняются электронные группировки (октет, пара электронов).
Первый механизм характеризуется тем, что все смещенные электронные пары остаются связанными в своих первоначальных октетах. Наличие таких смещений впервые предположил Льюис, который показал, как электрическая асимметрия возникающая вследствие неэквивалентного распределения электронов между разными атомами, т.е. вследствие их электроположительности или электроотрицательности, может распространяться вдоль цепи связанных атомов по механизму электростатической индукции.
Это называется индуктивным механизмом электронных смещений.
 Влияние атомов и групп, вызывающих такого рода электронные смещения, называется ИНДУКЦИОННЫМ ЭФФЕКТОМ. Графически индукционный эффект обозначается прямой стрелкой. ()
Влияние атомов и групп, вызывающих такого рода электронные смещения, называется ИНДУКЦИОННЫМ ЭФФЕКТОМ. Графически индукционный эффект обозначается прямой стрелкой. ()
Условным стандартом, от которого ведется отсчет эффекта принят атом водорода в связи
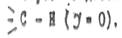
Если другой атом или группа притягивает электроны сильнее, чем водород, то в данном случае проявляется отрицательный индукционный эффект (-I), если такое притяжение сильнее притяжения водорода, проявляется положительный индукционный (+I) эффектом.



 (+I): С С С Х-δ (-I)
(+I): С С С Х-δ (-I)
 С С С Х+δ (+I)
С С С Х+δ (+I)
 |
Таким образом, индукционному эффекту принято приписывать знак заряда, который приобретает заместитель.
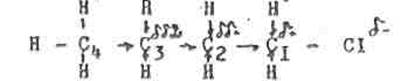 |
Рассмотрим этот вид электронных смешений на примера некоторого алкилхлорида.
Более электроотрицательный атом хлора оттягивает на себя электронную плотность по связи «С—CL». В результате атом СL имеет некоторый недостаток электронов, и приобретает частичный положительный заряд, который он стремиться компенсировать за счет оттягивания электронной плотности по σ - связи (С2 - С3), и так же связей (С1 - Н), (С2 - Н) и далее по цепи. Следует отметить быстрое "затухание" индукционного эффекта при передаче по цепи простых связей. За пределами 4-го звена углеродной цепи, то есть на расстоянии примерно 0,6нм индуктивное влияние заместителей практически неощутимо. В нашем примере частичный отрицательный заряд на атоме хлора равен сумме частичных положительных зарядов всех атомов углерода и водорода.
|
|
|
На основании опытных данных заместители, оказывающие индукционный эффект, можно распределить следующим образом по уменьшению такого эффекта:
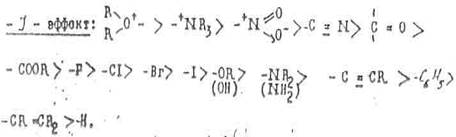
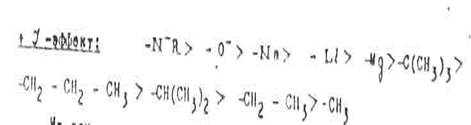
Из этих рядов можно сделать следующие выводы:
1. Величина индукционного эффекта акцепторных групп тем больше, чем правее и выше находится элемент, соответствующий центральному атому группы, в Периодической системе. Например, отрицательный индукционный эффект галогенов увеличивается от иода к фтору.
2. Индукционный эффект возрастает с увеличением заряда группы.
3. Индуктивное электроноакцепторное взаимодействие групп увеличивается при переходе от Sp3 к Sp2 и Sp гибридизованному атому углерода.
4. Все группы, имеющие гетероатомы с двойными связями, обладают свойствами акцепторов электронов.
Влияние полярности на физические свойства.
Полярные органические молекулы склонны к образованию водородных связей, наличие которых приводит к значительному росту температур плавления и кипения веществ, а так же к увеличению растворимости в воде (за счет образования водородных связей между молекулами вещества и молекулами воды). Чем больше полярность молекулы, тем прочнее образуемые водородные связи. Для примера сравним температуры кипения неполярных алканов, полярных одноатомных спиртов и карбоновых кислот с одинаковым числом атомов углерода в молекуле:
|
|
|
| Название и формула вещества | Температура кипения (0C) |
| Метан (CH4) | +161.5 |
| Метанол (CH3OH) | |
| Муравьиная кислота (HCOOH) | 100.7 |
| Этан (CH3 – CH3) | -88.6 |
| Этанол (CH3 – CH2 – OH) | |
| Уксусная кислота (CH3 – COOH) | |
| Хлоруксусная кислота (CL - CH2 – COOH) |

Интересно, что для карбоновых кислот кроме цепочечной ассоциации
Молекул более характерна циклическая ассоциация молекул:
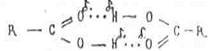
Образующиеся димеры связаны более прочной "двойной" водородной связью, которая не разрушается при испарении (в отличии от воды и спиртов). Например, уксусная кислота в парах существует в виде димера, что подтверждается расчетами молекулярной массы по плотности пара: 120 а. е. м, вместо 60.
Межмолекулярные водородные связи образуются и у аминов. Результатом является повышенная растворимость аминов в воде и увеличение температур кипения по сравнению с неполярными соединениями приблизительно той же молекулярной массы: сравним Ткип н-пентана – 360 С и
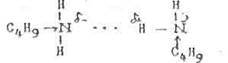
н-бутиламина – 780 С
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 1307; Нарушение авторских прав?; Мы поможем в написании вашей работы!