
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение. Определить минимальную ошибку в определении скорости шарика массой 1 мг, если неопределенность его координаты равна 1 мкм
|
|
|
|
Формула де Бройля....
Определить минимальную ошибку в определении скорости шарика массой 1 мг, если неопределенность его координаты равна 1 мкм.
A) 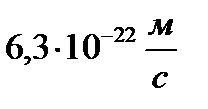
B) 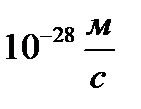
C) 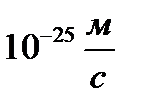
D) 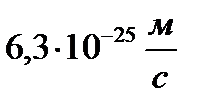
E) 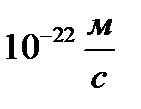
A) 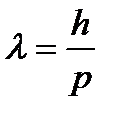
B) 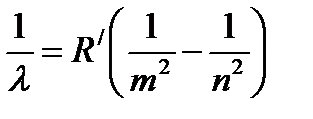
C) 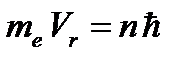
D) 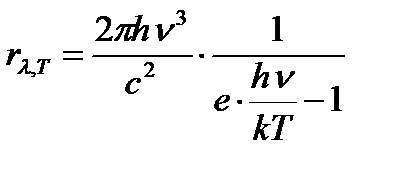
E) 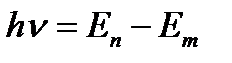
Спектры излучения разряженных газов, находящихся в возбужденном состоянии, состоят из отдельных линий и поэтому называются линейчатыми. Линии в таких спектрах расположены неравномерно и образуют группы называемые сериями. Первой была обнаружена серия линий атомарного водорода в видимой области. В последствии оказалось, что серии существуют в ультрафиолетовой и инфракрасной частях спектра. Расположение линий в сериях может быть представлено обобщенной формулой Бальмера - Ридберга:
n = С / l = R (1/ n 2 - 1/ m 2), (1)
где n - частота излучения, С - скорость света, l - длина волны, R - постоянная Ридберга, n и m - целые числа (для видимой области спектра n = 2, m = n +1).
Происхождение атомных спектров было впервые объяснено Н. Бором, частично использовавшим положения квантовой теории излучения. В своей работе он постулировал, что электроны в атомах движутся вокруг ядер по круговым орбитам, среди которых разрешенными являются только определенные. Электрон на такой орбите обладает определенным значением энергии (Е1 , Е2 , Е3,...) и движется по ней, не излучая и не поглощая энергии. Подобные орбиты называются стационарными орбитами или состояниями.
Излучение света происходит в тот момент, когда электрон переходит из одного стационарного состояния c большим значением энергии Еm, в другое с меньшей энергией Еn. При каждом переходе электрона, энергия атома меняется дискретно (квантуется) и излучается один световой фотон, энергия которого
e = hn =½ Еm - Еn ½, (2)
|
|
|
 где h - постоянная Планка, Еn и Еm - энергия электрона соответственно в нижнем и верхнем стационарном состоянии (рис. 1).
где h - постоянная Планка, Еn и Еm - энергия электрона соответственно в нижнем и верхнем стационарном состоянии (рис. 1).
Наряду с квантованием энергии, в боровской теории, постулируется квантование момента импульса L электрона массой mе, движущегося по орбите радиуса r со скоростью v
L = mе v r = n h /2 p. (3)
Постулаты Бора дают возможность вычислить радиусы и скорости движения электрона в атоме для любой стационарной орбиты. Для этого необходимо воспользоваться условием устойчивого движения электрона по орбите (равенство сил, действующих на электрон)
Z e2 / 4p eо r2 = mеv2 / r, (4)
где Z - число электронов в атоме (в случае атома водорода Z = 1), е - заряд электрона, eо – электрическая постоянная.
Решая совместно (3) и (4), получим:
r = n2 e0 h2 / p e2 mе (5) и v = n h /2 p mе r (6)
Энергия атома складывается из кинетической энергии электрона Еk (ядро атома считаем покоящимся) и потенциальной энергии Еp взаимодействия электрона с ядром.
Ек = е2 / 8 p eо r (7) и Eр = - е2 / 4 p eо r (8)
Полная энергия атома Е равна сумме Ek и Ep (с учетом 5)
Е = - е2 / 8 p eо r = - mе e4 / (8 n2 eo2 h2) (9)
В соответствии с теорией Бора величины n, r, и Е также являются квантованными. В зависимости от главного квантового числа n = 2, 3, 4,... они принимают ряд дискретных значений.
Из уравнений (9), (1) и (2) нетрудно получить частоту излучения, которая соответствует переходу электрона с более удаленной m -орбиты на более близкую к ядру n -орбиту, атома:
n = Еm - En / h = mе e4 (1 / n2 – 1 / m2) / 8 eo2 h3. (10)
Так как длина волны l, частота n и скорость света С связаны между собой формулой n = С / l, то
1 / l = me e4 (1 / n2 – 1 / m2) (11)
Равенство (11) хорошо описывает сериальные закономерности атома водорода.
Сравнивая последнее выражение с (1), получим значение постоянной Ридберга, выраженное через атомные константы:
R = mе е4 / (8 eo2 h3). (12)
Изложенная выше элементарная теория была подвергнута дальнейшему развитию, но присущие ей, наряду с достоинствами серьезные недостатки, привели к созданию квантовой теории излучения. Согласно этой теории постулируется двойственность характера элементарных частиц (в том числе и электронов), а все величины, характеризующие состояния атома, получены при решении уравнения Шредингера.
|
|
|
ОПИСАНИЕ УСТАНОВКИ
 В данной работе исследуется излучение водорода, находящегося в возбужденном состоянии. Водород помещен в Н-образную стеклянную трубку с двумя электродами. К электродам приложено высокое напряжение от источника, которое ионизирует газ в трубке, заставляя его светиться (трубка и источник питания расположены в одном блоке - Осв. (рис. 2)). Это излучение направляется в призменный монохроматор - М. Призма монохроматора разлагает падающее на нее излучение в спектр. Линии спектра можно наблюдать глазом через окуляр - Ок. В поле зрения окуляра находится указатель - Ук, освещаемый лампочкой через сменные светофильтры - Ф. Призма монохроматора может поворачиваться с помощью барабана - Б, вращение которого позволяет по очереди подводить к указателю цветные линии спектра и отсчитывать их положение по шкале, нанесенной на поверхность барабана. Воспользовавшись градуировочным графиком, прилагаемым к работе, определяют длины волн наблюдаемых линий. На стойке монохроматора находятся два выключателя:
В данной работе исследуется излучение водорода, находящегося в возбужденном состоянии. Водород помещен в Н-образную стеклянную трубку с двумя электродами. К электродам приложено высокое напряжение от источника, которое ионизирует газ в трубке, заставляя его светиться (трубка и источник питания расположены в одном блоке - Осв. (рис. 2)). Это излучение направляется в призменный монохроматор - М. Призма монохроматора разлагает падающее на нее излучение в спектр. Линии спектра можно наблюдать глазом через окуляр - Ок. В поле зрения окуляра находится указатель - Ук, освещаемый лампочкой через сменные светофильтры - Ф. Призма монохроматора может поворачиваться с помощью барабана - Б, вращение которого позволяет по очереди подводить к указателю цветные линии спектра и отсчитывать их положение по шкале, нанесенной на поверхность барабана. Воспользовавшись градуировочным графиком, прилагаемым к работе, определяют длины волн наблюдаемых линий. На стойке монохроматора находятся два выключателя:
один из них - «Сеть» предназначен для включения установки; второй - «Индекс» позволяет включать освещение указателя.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1284; Нарушение авторских прав?; Мы поможем в написании вашей работы!