
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 2. Определение точной концентрации приготовленного раствора титрованием его серной кислотой известной концентрации
|
|
|
|
Нормальной концентрации
Опыт 1. Приготовление раствора гидроксида натрия заданной
Лабораторная работа №3
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРОВ
Цель работы: определение точной концентрации приготовленного раствора гидроксида натрия титрованием его 0,1 М раствором серной кислоты.
Важнейшие понятия: дисперсные системы, дисперсная фаза, дисперсионная среда, типы дисперсных систем; растворы, растворитель, растворенное вещество, растворимость; концентрация, способы выражения концентраций (молярная, нормальная, моляльная, процентная концентрации, титр); общие свойства растворов (закон Рауля, осмотическое давление)
Следует уметь: давать определения важнейшим понятиям, использовать способы выражения концентраций для определения концентрации раствора, уметь перейти от одного способа выражения концентрации к другому; использовать законы, характеризующие общие свойства растворов для нахождения температуры замерзания и температуры кипения растворов, определения молярной массы растворенного вещества, осмотического давления и давления насыщенного пара над раствором.
Экспериментальная часть
Рассчитайте, какую массу NaOH нужно взять для приготовления 0,5 л 0,05 н раствора. На технических весах взвесьте (с точностью до 0,1 г) вычисленную массу. Навеску аккуратно перенесите в мерную колбу объемом 0,5 л и долейте до метки дистиллированной водой. Тщательно перемешайте раствор.
В бюретку налейте 0,1 н раствор H2SO4 почти доверху, осторожно слейте до нулевого значения (следите, чтобы нижняя часть бюретки была заполнена). В коническую колбу отмерьте пипеткой определенный объем щелочи, добавьте 1-2 капли индикатора метилового оранжевого. Затем к данному раствору добавляйте небольшими порциями кислоту из бюретки, непрерывно перемешивая раствор круговыми движениями колбы. Окраска индикатора должна измениться до розовой от одной избыточной капли кислоты. Отметьте объем раствора серной кислоты, пошедшей на титрование. Повторите определение три раза. Расхождение между титрованиями не должно превышать 0,1 мл. Результаты определения занесите в таблицу 3.1.
|
|
|
Найдите среднее значение объема кислоты и по формуле 
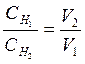 и
и
рассчитайте нормальную концентрацию щелочи.
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРОВ
Цель работы: определение точной концентрации приготовленного раствора гидроксида натрия титрованием его 0,1 М раствором серной кислоты.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Раствором называется
____________________________________________________________________________________________________________________________________
Концентрация раствора определяется
____________________________________________________________________________________________________________________________________
Способы выражения концентрации растворов:
1._________________________________________________________________2._________________________________________________________________3._________________________________________________________________4._________________________________________________________________
5._________________________________________________________________
Титрование – это
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Титрованный раствор – это
__________________________________________________________________
Опыт 1. Приготовление раствора гидроксида натрия заданной нормальной концентрации.
Нормальная концентрация Сн определяется
______________________________________________________________________________________________________________________________________________________________________________________________________и измеряется_______________________________________________________
Молярная масса эквивалента МЭ сложного вещества рассчитывается по формуле
|
|
|
__________________________________________________________________и измеряется_______________________________________________________
МЭ гидроксида натрия = _____________________________________________
Масса NaOH, необходимая для приготовления 0,5 л 0,05 н раствора
m = __________________________________________________________________
Опыт 2. Определение точной концентрации приготовленного раствора титрованием его серной кислотой известной концентрации.
Используемая при титровании реакция:
__________________________________________________________________
Точка эквивалентности
____________________________________________________________________________________________________________________________________устанавливается с помощью
______________________________________________________________________________________________________________________________________________________________________________________________________
Метиловый оранжевый в щелочном растворе окрашен ___________________
в кислом растворе окрашен __________________________________________
Таблица 3.1
| № п/п | Объем щелочи V1, мл | Объем кислоты V2, мл |
Cреднее значение объема кислоты = 


По формуле 
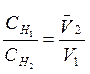 , где
, где 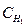 – концентрация щелочи,
– концентрация щелочи, 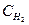 - концентрация кислоты, рассчитайте нормальную концентрацию щелочи.
- концентрация кислоты, рассчитайте нормальную концентрацию щелочи.
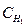 (NaOH) =
(NaOH) =
Вывод:
____________________________________________________________________________________________________________________________________
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1709; Нарушение авторских прав?; Мы поможем в написании вашей работы!