
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Индикаторы метода кислотно-основного титрования
|
|
|
|
При протекании реакции нейтрализации не наблюдается каких-либо внешних признаков (эффектов), которые можно было бы наблюдать визуально. Поэтому для фиксирования точки эквивалентности необходимо применять соответствующие индикаторы. Последние меняют окраску в зависимости от изменения величины рН раствора, вследствие чего их называют рН индикаторами,
Известно довольно большое количество веществ, обладающих этим свойством, но не все они могут использоваться в качестве индикаторов. Вещества, которые можно применять в качестве индикаторов, должны удовлетворять определенным требованиям:
1. окраска индикатора должна быть хорошо заметной;
2. цвет индикатора должен резко изменяться в небольшом интервале рН,
3. изменение окраски должно быть обратимым.
Окраска индикаторов метода кислотно-основного титрования меняется в определенном интервале значений рН, часто не строго в точке эквивалентности, а с некоторыми отклонениями как в ту, так и в другую сторону. Эту погрешность называют индикаторной ошибкой титрования.
Механизм химико-физических процессов, вызывающих изменение окраски индикаторов, оставался неясным до конца XIX столетия и только В. Оствальдом (1894) была предложена ионная теория индикаторов, основанная на теории электролитической диссоциации. Согласно этой теории индикаторы метода кислотно-основного титрования рассматриваются как органические кислоты или основания, у которых цвет недиссоциированных молекул и ионов имеет различную окраску. Так, если взять лакмус, то в водных растворах недиссоциированные молекулы имеют красную окраску, анионы - синюю.
Реакцию диссоциации этого соединения можно выразить следующей схемой: Hind ↔ H+ + Ind-,
|
|
|
красное синее
т. е. молекулы лакмуса в данном случае играют роль донора протонов, и если к раствору добавить 1—2 капли раствора гидроксида натрия, то ОН- ионы соединяются с Н+ ионами, и образуют молекулу воды. Поэтому равновесие сдвинется вправо и окраска раствора станет синей вследствие появления ионов Ind-.
При добавлении 1-2 капель раствора соляной кислоты равновесие сместится в сторону образования Hind и раствор приобретет красную окраску. В случае нейтральной реакции молекулы и ионы Hind и Ind- будут находиться в эквивалентном количестве и цвет раствора будет фиолетовым.
Следовательно, одни индикаторы будут донорами протонов- кислотные индикаторы, а другие могут играть роль акцептора Н+ -ионов, т. е. будут основными согласно схеме:
IndOH +H+ ↔ Ind+ + H2O
Индикаторы, имеющие две окрашенные формы, называют двухцветными (лакмус, метиловый оранжевый, метиловый красный и др.), а имеющие только.одну окраску (одну форму) — одноцветными (фенолфталеин).
Ионная теория индикаторов наглядно объясняет механизм изменения окраски их под влиянием ионов Н+ и ОН-, поступающих в раствор. Она допускает и количественную интерпретацию. Ионная теория не дает полного представления о влиянии строения органических веществ на цветность их.
Как известно, окраска органических соединений зависит от наличия в их молекулах особых групп атомов, называемых «носителями цвета» -хромофорами. Так, например, хромофорами являются карбонильные группы, расположенные в определенной последовательности, нитрогруппа О = N ®, которая может переходить в нитрозогруппу НО—N =, азогруппа — N = N —, превращающаяся в гидразогруппу
= N—NH —, бензойная группа переходящая в хиноидную и др.
Кроме хромофорных групп, на окраску веществ влияет наличие и других групп, которые усиливают интенсивность окраски первых. К этим группировкам атомов относятся гидроксильная группа ОН-, аминогруппа —NH2, эфирная группа —О—СН3, радикальная группа
|
|
|
—С2Н5 и др. Эти группы называются ауксохромными.
Дальнейшие, более глубокие исследования механизма действия индикаторов показали, что ионная теория Оствальда не полностью раскрывает действительное положение вещей. Как выяснилось, окраска индикаторов зависит не только от диссоциации (ионизации) молекул индикатора, но и от их структуры и наличия в них хромофорных и ауксохромных группировок. Эти положения послужили основанием к возникновению новой теории индикаторов— хромофорной.
Согласно основным ее положениям, вследствие изменения рН раствора происходит внутримолекулярная перегруппировка атомов, а как результат этого - изменение окраски раствора. Эта перегруппировка атомов — явление обратимое и носит название таутомерной изомерии. Следовательно, индикаторы могут находиться в двух таутомерных формах и одна форма (в зависимости от величины рН) может переходить в другую. Данный процесс будет происходить до тех пор, пока не установится определенное состояние равновесия между ними. Например, для фенолфталеина устанавливается равновесие между бензольной и хиноидной структурами. Молекула фенолфталеина имеет три бензольных ядра, и одно из них может претерпевать хиноидную перегруппировку, которая и является хромофором, что хорошо видно из следующего уравнения:
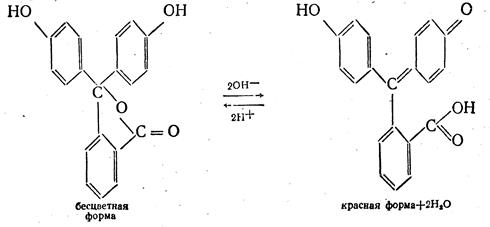
Кроме того, молекула индикатора содержит две гидроксильные и одну карбоксильную группы, которые тоже претерпевают изменения. При введении в раствор ОН- -ионов происходит депротонизация и образование хиноидной структуры и двух молекул воды. При этом равновесие смещается вправо и раствор индикатора приобретает красный цвет. При введении в раствор ионов Н+ происходит обратный процесс, равновесие смещается влево и красная окраска постепенно исчезает. На основании этих данных фенолфталеин относят к кислотным индикаторам.
Необходимо отметить, что равновесие процесса таутомерных превращений происходит не сразу, а постепенно, в то время как равновесие диссоциации устанавливается мгновенно. Поэтому при титровании изменение окраски индикатора происходит во времени. Все это еще раз подтверждает, что ионная теория индикаторов не объясняет полностью процесс изменения окраски их.
|
|
|
По современным представлениям, наиболее вероятной является ионно-хромофорная теория индикаторов, согласно которой изменение окраски индикаторов вызывается присоединением к молекуле их ионов Н+ или отнятием (отщеплением) ионов Н+, что в свою очередь влечет за собой изменение структуры молекулы индикаторов. Таким образом, две рассмотренные теории фактически объединяются в одну ионно-хромофорную. Кроме изложенных теорий, существуют координационно-ионная, хинофенолятная и др.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 6676; Нарушение авторских прав?; Мы поможем в написании вашей работы!