
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смещение равновесия в процессах гидролиза солей
|
|
|
|
Так как гидролиз большинства солей является обратимым процессом, то степень гидролиза можно изменять, смещая равновесие реакций гидролиза и нейтрализации.
Важнейшими факторами, влияющими на степень гидролиза, являются:
1) константа диссоциации кислоты или основания, образующих соль;
2) общая концентрация соли;
3) температура;
4) рН раствора.
Влияние первого фактора видно из формулы Кг=  (таблица 2).
(таблица 2).
1) Константа гидролиза тем больше, чем меньше Кдисс. электролита, то есть чем слабее образующийся электролит, тем сильнее гидролизуется соль.
Из уравнения h = 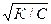 следует, что разбавление раствора усиливает гидролиз, а повышение концентрации соли подавляет его.
следует, что разбавление раствора усиливает гидролиз, а повышение концентрации соли подавляет его.
2) Влияние температуры на степень гидролиза можно вывести из принципа Ле-Шателье.
| Тип соли | Реакция растворов | Продукты гидролиза | Кг | h | [H+] или [OH-] |
| Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону). | Кислая, pН< 7 | Слабые основания или основные соли | 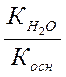
| 
| [H+]=   = =

|
| Cоль, образованная слабой кислотой и сильным основанием (гидролиз по аниону) | Щелочная pН>7 | Слабые кислоты или кислые соли | 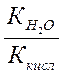
| 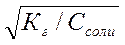
| [ОH-] = 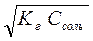 [H+] =
[H+] = 
|
| Соль, образованная слабым основанием и слабой кислотой (гидролиз по аниону и по катиону). | Близкая к нейтральной pН = 7 | Слабые кислоты и слабые основания или кислые соли | 
|  = = 
| [H+] =
= 
|
| Кислая соль, образованная слабой двухосновной кислотой и сильным основанием | pН>7 (Kг > Kкисл) рН <7 (Kг<Kкисл) | Слабая кислота | 
| 
| [H+] = 
|
Таблица 2 – Качественные и количественные характеристики растворов гидролизующих солей
Реакция нейтрализации – экзотермична, следовательно, гидролиз, (обратный ей процесс) эндотермичен, как и диссоциация воды.
|
|
|
Поэтому при повышении температуры раствора гидролиз усиливается, охлаждение раствора подавляет гидролиз.
Выше было показало, что при гидролизе солей по катиону образуется кислая среда, при гидролизе по аниону – щелочная. Поэтому, изменяя рН раствора, можно усиливать или подавлять гидролиз. Так, введение в раствор FеС13 кислоты вызовет смещение равновесия влево, то есть степень гидролиза уменьшится. Наоборот, связывание ионов Н+ усилит гидролиз.
Поэтому при сливании растворов солей, одна из которых гидролизуется по катиону, а другая – по аниону, происходит взаимное усиление гидролиза и гидролиз может протекать необратимо. Так, в растворах FеС13 и Na2S, взятых в отдельности, протекает практически только по первой ступени. При сливании этих растворов происходит реакция нейтрализации:
Н+ + ОН- = Н2О
или в молекулярной форме
НСl + NaOH = H2O + NaCl,
и равновесие гидролиза (1) и (5) смещаются вправо, становятся возможными вторая и третья (3), (4) стадии гидролиза, что приводит к необратимому протеканию совместного гидролиза этих двух солей:
FeCl2 + 3Na2S + 6HOH = 2Fe(OH)3  + 3H2S
+ 3H2S  + 6NaCl
+ 6NaCl
или Fe3+ + 3S2- + 6HOH = 2Fe(OH)3 + 3H2S
По подобной схеме взаимного усиления гидролиза, приводящего к образованию осадка и газа, взаимодействуют соли, образованные катионами Аl3+, Cr3+, Fe3+ c карбонатами и сульфидами щелочных металлов. Поэтому эти соли невозможно получить реакциями обмена из водных растворов.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 1813; Нарушение авторских прав?; Мы поможем в написании вашей работы!