
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина. Відомча класифікація видатків (за відомствами, які відповідають за оборону), млрд
|
|
|
|
ЗАНЯТТЯ №1
Відомча класифікація видатків (за відомствами, які відповідають за оборону), млрд. грн..
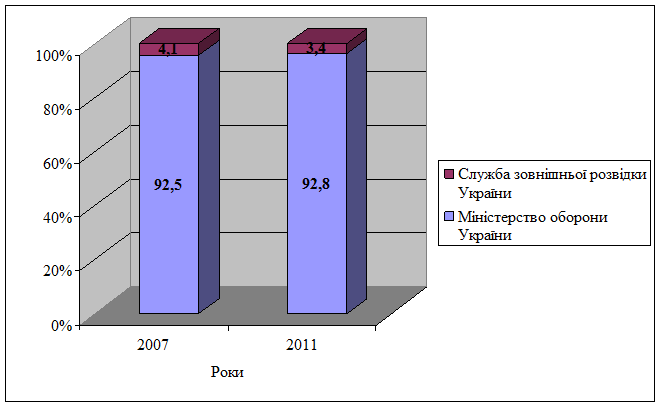
Рис. Відомства з найбільшою часткою витрат на оборону
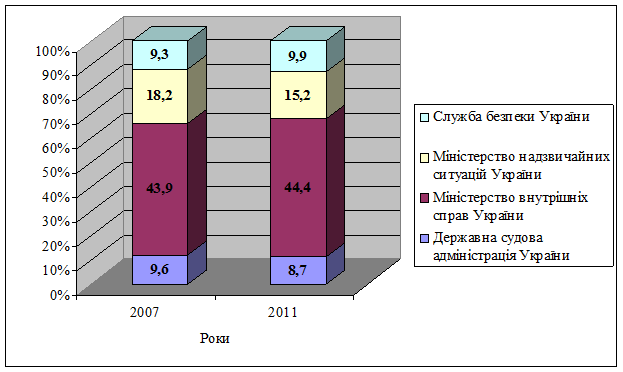
Рис. Відомства з найбільшою часткою витрат на підтримання громадського порядку, безпеки та судову владу
Відомча класифікація видатків (за відомствами, які відповідають за підтримання громадського порядку, безпеки та судову владу)
| Код | Відомства, які відповідвють за громадський порядок, безпеку та судову владу | ||||||||||
| Видатки загалом | Питома вага в видатках, % | Видатки загалом | Питома вага в видатках,% | Видатки загалом | Питома вага в видатках, % | Видатки загалом | Питома вага в видатках, % | Видатки загалом | Питома вага в видатках, % | ||
| Державна судова адміністрація України | 1,704 | 9,6 | 2,392 | 10,2 | 2,133 | 9,1 | 2,565 | 9,34 | 2,745 | 8,7 | |
| Верховний Суд України | 0,137 | 0,8 | 0,165 | 0,7 | 0,122 | 0,5 | 0,137 | 0,50 | 0,095 | 0,3 | |
| Вищий спеціалізований суд України з розгляду цивільних і кримінальних справ | х | х | х | х | х | х | 0,007 | 0,03 | 0,127 | 0,4 | |
| Вищий господарський суд України | 0,066 | 0,4 | 0,074 | 0,3 | 0,063 | 0,3 | 0,074 | 0,27 | 0,119 | 0,4 | |
| Вищий адміністративний суд України | 0,055 | 0,3 | 0,065 | 0,3 | 0,049 | 0,2 | 0,066 | 0,24 | 0,083 | 0,3 | |
| Конституційний Суд України | 0,041 | 0,2 | 0,058 | 0,2 | 0,053 | 0,2 | 0,06 | 0,22 | 0,059 | 0,2 | |
| Генеральна прокуратура України | 0,829 | 4,7 | 1,159 | 4,9 | 1,014 | 4,3 | 1,26 | 4,59 | 2,34 | 7,4 | |
| Міністерство внутрішніх справ України | 7,795 | 43,9 | 10,29 | 43,8 | 10,808 | 46,1 | 12,942 | 47,14 | 14,061 | 44,4 | |
| Міністерство надзвичайних ситуацій України | 3,239 | 18,2 | 4,046 | 17,2 | 3,874 | 16,5 | 4,108 | 14,96 | 4,815 | 15,2 | |
| Міністерство надзвичайних ситуацій України (загальнодержані витрати) | 0,009 | 0,1 | 0,009 | 0,0 | 0,003 | 0,0 | 0,004 | 0,01 | 0,003 | 0,0 | |
| Міністерство юстиції | 0,754 | 4,2 | 1,157 | 4,9 | 1,1 | 4,7 | 1,315 | 4,79 | 1,449 | 4,6 | |
| Адміністрація державної прикордонної служби України | 1,313 | 7,4 | 1,812 | 7,7 | 1,89 | 8,1 | 2,134 | 7,77 | 2,337 | 7,4 | |
| Вища рада юстиції | 0,011 | 0,1 | 0,016 | 0,1 | 0,013 | 0,1 | 0,017 | 0,06 | 0,043 | 0,1 | |
| Служба безпеки України | 1,645 | 9,3 | 2,044 | 8,7 | 2,114 | 9,0 | 2,529 | 9,21 | 3,14 | 9,9 | |
| Управління державної охорони України | 0,159 | 0,9 | 0,183 | 0,8 | 0,189 | 0,8 | 0,238 | 0,87 | 0,286 | 0,9 | |
| Разом | 17,757 | 23,47 | 23,425 | 27,456 | 31,702 |
|
|
|
ТЕМА: Правила роботи і безпеки в хіміко-аналітичній лабораторії. Кислотно-основна класифікація катіонів. Дія групових реактивів. Аналітичні реакції катіонів I-III-ї аналітичних груп (Натрію, Калію, Амонію, Арґентуму, Кальцію), умови їх виконання.
АКТУАЛЬНІСТЬ ТЕМИ: Майбутній спеціаліст-провізор повинен знати правила техніки безпеки при роботі з реактивами та хімічним посудом, і в разі необхідності, вміти кваліфіковано надати першу допомогу.
Вміння використовувати хіміко-аналітичні властивості катіонів для їх розділення та ідентифікації дає можливість застосовувати отримані навики при вивченні фармацевтичного, фітохімічного та хіміко-токсикологічного аналізу.
НАВЧАЛЬНІ ЦІЛІ ЗАНЯТТЯ:
ЗНАТИ: -правила роботи в лабораторії аналітичної хімії;
-властивості сполук катіонів I-III-ї аналітичної групи;
-класифікацію катіонів на аналітичні групи;
-закон діючих мас.
ВМІТИ: -правильно і безпечно користуватись хімічними реактивами і
посудом;
-працювати з центрифугою, електричними та нагрівальними
приладами;
-надавати першу допомогу при нещасних випадках;
-виконувати характерні реакції катіонів I-ІІІ-ї аналітичних груп;
-центрифугувати, випаровувати, перевіряти повноту
осадження та проби забарвлення полум’я;
-робити висновки з результатів аналізу і оформляти їх у
вигляді протоколу.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Яким чином слід нагрівати розчини в пробірках?
|
|
|
2.Як треба перевіряти запах рідини в пробірках?
3.Правила роботи з центрифугою.
4.Як і де необхідно працювати з речовинами, при взаємодії яких утворюються отруйні для організму гази?
5.Описати в зошиті методи якісного аналізу (пробірковий, мікрокристалічний, крапельний, макро-, мікро- та напівмікрометоди).
6.Специфічність і чутливість реакцій.
7.Якісні аналітичні реакції (мікрокристалоскопічні, кольорові, крапельні, осадові, характерні, специфічні, групові).
8.Реакції, що виконуються “сухим” та “мокрим” шляхом. Дробний та систематичний методи аналізу.
9.Поділ катіонів на аналітичні групи за кислотно-основною класифікацією.
КОНТРОЛЬНІ ПИТАННЯ
1.Написати характерні реакції катіонів I-ІІІ-ї аналітичних груп.
2.Як виявити йони Калію в розчині, що містить йони Амонію?
3.Чому катіони I-ї аналітичної групи не мають групового реагенту?
4.Які реакції виявлення катіонів Натрію, Калію, Амонію, Арґентуму, Кальцію? Відповідь обґрунтуйте і запишіть.
5.Як слід брати сухі речовини та рідини зі склянок і штанглазів?
6.Яким чином треба працювати з концентрованими кислотами і лугами?
7.Як необхідно працювати з речовинами, які легко спалахують (бензин, диетиловий етер, спирти, бензол, ацетон тощо)?
8.Перша допомога при попаданні на шкіру і в очі кислот та лугів.
9.Перша допомога при порізах та опіках.
10.Чому при аналізі катіонів першої аналітичної групи йон амонію виявляють методом попередніх досліджень? Дати письмову відповідь.
11.Які йони заважають виявленню йонів амонію при взаємодії з реактивом Неслера?
12.Застосування катіонів I-ї аналітичної групи в фармацевтичній і медичній практиці.
БІОЛОГІЧНА РОЛЬ І МЕДИЧНЕ ЗАСТОСУВАННЯ
СПОЛУК I-ї АНАЛІТИЧНОЇ ГРУПИ КАТІОНІВ
В організмі людини й тварин йони Na+ і K+ містяться в макрокількостях і тому є життєво необхідними. Загальний вміст Натрію в організмі трохи більший від вмісту Калію: 0,25 і 0,22 % відповідно за масою. Основна біологічна роль цих йонів полягає у підтриманні водно-електролітного балансу, осмотичного тиску, кислотності біорідин. Катіони s1-елементів необхідні для генерування біопотенціалів у нервовій системі та для регулювання роботи серцевого м'яза. Якщо катіон Na+ є основним позаклітинним, то К+ - внутрішньоклітинним йоном, що і є причиною виникнення біопотенціалів у клітинах.
|
|
|
Натрію хлорид NaCl, що постійно надходить в організм з їжею, є джерелом хлоридної кислоти для утворення шлункового соку. Крім того, його використовують в медицині у вигляді ізотонічного (0,9%) і гіпертонічного розчинів. Ізотонічний розчин вводять внутрішньовенно при втратах крові і застосовують при фізіологічних експериментах, а гіпертонічний – для хірургічних перев’язок.
Натрію гідрогенкарбонат NаНСО3 є важливим компонентом буферної суміші, яка підтримує кислотно-основний стан деяких біорідин, служить для нейтралізації підвищеної кислотності шлункового соку.
Натрію бромід NaBr використовують в якості речовини, яка заспокоює нервову систему.
Натрію сульфат Na2SO4•10H2O застосовують як послаблюючий засіб.
Йон амонію NH4+ також віднесений до першої аналітичної групи катіонів, оскільки поводить себе аналогічно до йонів лужних металів, утворюючи добре розчинні у воді солі. При нагріванні солі амонію легко розкладаються, а продукти їх розкладання випаровуються. Користуючись цією властивістю, солі амонію можна повністю видалити із суміші інших неорганічних речовин.
Оскільки Нітроген входить до складу молекул значної кількості органічних сполук - біогенних амінів, білків, нуклеотидів, гемоглобіну, вітамінів, а кінцевим продуктом обміну цих речовин є сечовина і сечова кислота, то визначення катіонів амонію в біорідинах має велике значення для діагностики та лікування багатьох захворювань.
10%-ий розчин аміаку у воді – амонію гідроксид NH4OH – під назвою “нашатирний спирт” використовують для збудження дихальних центрів при втраті свідомості.
В організмі людини йони срібла знаходяться у мінімальних кількостях у мозку, крові, печінці, кістках, пігментах очей і залозах внутрішньої секреції.
Із сполук Аргентуму добре розчиняється у воді нітрат, який використовують для оздоблення (посріблення) різних предметів, виготовлення фотоматеріалів, а у медичній практиці — як антисептичний засіб. Здавна бактерицидні властивості йонів Ag+ використовують для знезараження питної води, виготовлення бактерицидної вати та марлі, для лікування хворіб шкіри і важкозаживаючих язв.
|
|
|
Крім того, Аргентуму нітрат AgNO3 використовують в медицині для припікання ран.
Йони Са2+ постійно містяться в організмі людини й тварин у макрокількостях. Вони необхідні для побудови тканин, оскільки мінеральні солі Кальцію у вигляді гідроксіапатиту Са5ОН(РО4)3 є основою кісткової тканини, а фторапатит Са5F(РО4)3 — емалі зубів.
У плазмі крові йони Кальцію перебувають у зв'язаному з білками стані та у вільному йонізованому вигляді. Вони підтримують нормальну здатність крові до згортання, впливають на кислотно-основний стан біологічних рідин, виявляють протизапальну дію. Крім того, йони Кальцію регулюють поділ клітин, відіграють важливу роль у функціонуванні серцевого м'яза, гальмують збудження центральної нервової системи.
Нестача Кальцію в організмі призводить до нервових розладів. З медичних засобів, що містять Кальцій, важливими є хлорид, глюконат та лактат кальцію, які використовують як протизапальні, протиалергійні та кровоспинні препарати.
Кальцію сульфат CaSO4 застосовують в хірургії для приготування гіпсових пов’язок при переломах кісток, щоб надати їм нерухомості.
САМОСТІЙНА АУДИТОРНА РОБОТА
1.Виконати лабораторні роботи наведені в цих методичних вказівках.
2.Оформити і захистити протокол.
3.Відповісти на запитання, запропоновані викладачем, з використанням записів на дошці.
4.Розв'язувати розрахункові задачі, запропоновані викладачем.
Характерні реакції катіонів першої
аналітичної групи
а) Реакції катіонів Натрію
1.Реакція з цинкуранілацетатом Zn(UO2)3(CH3COO)8
(фармакопейна)
Поміщують краплю досліджуваного розчину солі Натрію на предметне скло і випаровують майже досуха на водяній ванні. Поряд поміщують 2 краплі цинкуранілацетату в ацетатній кислоті і скляною паличкою з’єднують реактив з залишком. Після цього (через 1-2 хв.) виділяються зеленувато–жовті тетраедри і октаедри натрію уранілацетату NaZn(UO2)3(CH3COO)9.
Na+ + Zn2+ + 3UO22+ + 8CH3COO- + CH3COOH + 9H2O →
→ NaZn(UO2)3(CH3COO)9•9H2O↓ + H+
Цю реакцію можна проводити в присутності інших катіонів, в т.ч. K+, Rb+, Cs+, NH4+. Чутливість реакції підвищується в присутності солей Цинку і Магнію. При цьому утворюються кристали складу, наприклад NaMg(UO2)3(CH3COO)9•9H2O. Реакція специфічна для йонів Na+.
Йони Mg2+, Ba2+, Sr2+, Ca2+, Zn2+, Mn2+, Al3+, Hg2+, Cu2+, Co2+, Ni2+, Cd2+ перешкоджають даній реакції тільки при концентраціях, що перевищують 0,005 г на 1см3.
2.Реакція з калію гексагідроксостибіатом K[Sb(OH)6]
Поміщають у пробірку 2-3 краплі солі Na+, додають до нього 2-3 краплі реактиву і труть скляною паличкою в стінки пробірки. При цьому випадає білий кристалічний осад.
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Умови проведення реакції
Реакцію слід проводити в строго нейтральному середовищі при pH = 7. У лужному середовищі осад не утворюється внаслідок утворення розчинної середньої солі. В кислому випадає білий аморфний осад стибіатної кислоти H3SbO4, який помилково може бути прийнятий за осад натрію антимонату. Кисле середовище нейтралізують розчином калію гідроксиду, лужне – розчином ацетатної кислоти.
Перевірити розчинність осаду при нагріванні та в ацетатній і хлоридній кислотах.
Дану реакцію використовують для осадження йонів Na+ з крові (чутливість – 50 мкг).
3.Проба на забарвлення полум’я
(фармакопейна)
Дослід виконують, вносячи крупинки солі на металевій дротинці в полум’я пальника або беручи на кінчик платинової дротинки краплю розчину солі Натрію. Леткі сполуки Натрію забарвлюють полум’я в характерний жовтий колір, який має зберігатись протягом 25-30 секунд.
б) Реакції катіонів Калію
4.Реакція з натрію гідротартратом або тартратною кислотою (фармакопейна)
Наливають у пробірку 2-3 краплі розчину солі Калію, додають 2-3 краплі розчину NaHC4H4O6 і труть скляною паличкою в стінки пробірки. Через деякий час випадає білий кристалічний осад:
KCl+ NaHC4H4O6 → KHC4H4O6↓ + NaCl
Вивчають властивості осаду:
а) розчинність у холодній та гарячій воді;
б) відношення до дії мінеральних кислот і лугів.
Чутливість реакції – 50 мкг, граничне розбавлення – 1:1000. Катіони NH4+ перешкоджають визначенню, тому їх усувають шляхом прожарювання проби.
Державна Фармакопея України (ДФУ) проводит дану реакцію з тартратною кислотою в присутності натрію ацетату.
5. Реакція з натрію гексанітрокобальтатом (ІІІ)
(фармакопейна)
Поміщають у пробірку 1-2 краплі розчину солі Калію, додають 2 краплі розчину реактиву і труть скляною паличкою в стінки пробірки. При цьому випадає жовтий кристалічний осад подвійної солі калію-натрію гексанітрокобальтату (ІІІ).
2KCl + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaCl
Реакцію проводять в слабокислому середовищі при рН = 4-7. В сильнокислому середовищі осад не випадає внаслідок утворення нестійкої кислоти Н3[Co(NO2)6], яка розкладається в момент виділення. В лужному середовищі випадає коричневий осад Co(OH)3, який заважає відкриттю йонів Калію.
6. Реакція забарвлення полум’я
(фармакопейна)
Чисту прожарену дротину зі сталі опускають в розчин калію хлориду і поміщають в полум’я, яке в цьому випадку забарвлюється в фіолетовий колір. Йони Натрію перешкоджає виявленню K+, але його можна розрізнити при розгляді через синій фільтр (кобальтове скло).
в) Реакції катіонів амонію (NH4+)
7. Дія гідроксидів лужних металів
(фармакопейна)
а) за запахом:
При нагріванні з лугами солі амонію розпадаються з виділенням газоподібного аміаку:
NH4++ OH- → NH3↑ + H2O
б) проба з червоним лакмусовим папірцем, або універсальним індикатором:
При проведенні попереднього досліду тримають змочений водою індикаторний папірець. При виділенні NH3 папірець синіє. Індикаторний папірець не повинен торкатися стінок пробірки для уникнення попадання на нього лугу.
8. Дія реактиву Неслера
Йони амонію з реактивом Неслера (K2[HgI4] + KOH) утворюють червоно-бурий осад амідного комплексу меркурію (II):
NH4+ + 2[HgI4]2- + 4OH- = [Hg2ОNH2]I↓ + 7I- + 3H2O
Реакцію виконують крапельним методом. На скляну пластинку поміщають 1-2 краплі досліджуваного розчину і додають 2-4 краплі реагенту.
Виявленню NH4+ перешкоджають катіони, які утворюють нерозчинні забарвлені гідроксиди і йодиди, а також йони Sn2+, Sb3+, які руйнують реактив Неслера.
9. Кип’ятіння солей амонію з натрію карбонатом
Під дією натрію карбонату солі амонію розкладаються з утворенням газоподібного аміаку. Нагрівання прискорює дану реакцію:
2NH4Cl + Na2CO3 → 2NH3↑ + 2NaCl + H2O + CO2↑.
У фарфорову чашку із досліджуваною рідиною додають розчин натрію карбонату, ставлять на піщану ванну і нагрівають. Аміак, який виділяється, виявляють за почервонінням змоченого водою і піднесеного до чашки фенолфталеїнового папірця.
Характерні реакції катіонів другої
аналітичної групи
г) Реакції йонів Аg+
10. Йони Аg+ в розчині виявляють за допомогою трьох
наступних реакцій
(фармакопейна з хлоридною кислотою)
а) AgNO3 + HCl = AgCl↓ + HNO3 (утворення білого осаду). Аргентуму хлорид під впливом світла розкладається і при цьому виділяється дрібнодисперсне металічне срібло і осад чорніє. Реакцію осадження проводять у кислих розчинах при рН менше 7;
б) AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O (розчинення осаду з утворенням безбарвного розчину);
в) [Ag(NH3)2]Cl + 2H2O + KI = AgI↓ + КCl + 2NH4OH (утворення жовтого осаду).
11. Реакція "срібного дзеркала”
(фармакопейна)
У чисту пробірку, попередньо добре вимиту хромовою сумішшю і водою, поміщують декілька крапель розчину AgNO3 і кілька крапель NH4OH до розчинення утвореного осаду, уникаючи надлишку аміаку. Додають декілька крапель розчину формальдегіду (формаліну) або розчину глюкози і занурюють пробірку в теплу воду. На стінках пробірки утворюється блискуче дзеркало металічного срібла:
2[Ag(NH3)2]OH + HCОH = 2Ag↓ + HCOONH4 + 3NH3 + H2O
Характерні реакції катіонів третьої
аналітичної групи
д) Реакції виявлення катіонів третьої аналітичної групи
(Ca2+)
Груповим реагентом є розбавлена (1М) сульфатна кислота.
12. Дія групового реагенту (H2SO4)
Йони Ca2+ утворюють з груповим реагентом білі дрібнокристалічні осади сульфатів, нерозчинні в розбавлених мінеральних кислотах і лугах.
Виконання реакцій:
До 1-2 см3 розчинів солей Са2+, Sr2+, Ba2+ в окремих пробірках додають 3-4 краплі розбавленої Н2SO4. Розчинність осадів у воді збільшується в ряду: ВаSO4 < SrSO4 < СаSO4. Розчинність СаSO4 у воді велика і для повного його виділення із розчину застосовують як "висолювач" етиловий спирт. Осади ВаSO4, SrSO4, СаSO4 розчинні в концентрованій Н2SO4 з утворенням гідросульфатів металів.
Кальцію сульфат, крім того, на відміну від ВаSO4 i SrSO4 розчиняється в надлишку амонію сульфату з утворенням безбарвної комплексної сполуки:
СаSO4 + (NH4)2SO4 = (NH4)2[Ca(SO4)2].
Цю реакцію використовують в аналізі для відділення Са2+ від Sr2+ i Ba2+.
Перевести в розчин ВаSO4, SrSO4, СаSO4 можна багаторазовим обробленням (5-6 разів) насиченим розчином Na2СО3 або 30 % розчином (NH4)2СО3 при нагріванні з наступним розчиненням карбонатів, що утворилися в ацетатній кислоті.
Дія загальних реагентів
13.. Дія лугів (NaOH, КОН) і амонію гідроксиду
Реагенти (не забруднені карбонатами, які можуть утворитися в результаті поглинання вуглекислого газу з повітря) не осаджують катioнів третьої групи.
14. Дія карбонатів натрію і амонію
Реагенти утворюють з катіонами білі аморфні (на холоді) або кристалічні (при нагріванні) осади карбонатів. Реакцію проводять в нейтральному або слаболужному середовищі.
Са2+ + CO32- → CaCO3↓
Осади добре розчинні в ацетатній та розбавлених мінеральних кислотах (крім розбавленої сульфатної кислоти).
15. Дія амонію оксалату
Реагент у нейтральному або слаболужному середовищі утворює з йонами Са2+, білі дрібнокристалічні осади оксалатів:
Са(NО3)2 + (NН4)2С2O4 = CaC2O4↓ + 2NH4NO3.
Всі осади добре розчинні у розбавлених НС1 і HNO3. В СН3СООН не розчиняється. Реакцію з (NН4)2С2O4 використовують в аналізі для виявлення Са2+ в розчині.
ЛІТЕРАТУРА
1.Болотов В.В., Свєчніков О.М., Колісник С.В. та ін. Аналітична хімія. — Харків: Видавництво НФаУ «Оригінал», 2004. — 479 с.
2.Державна фармакопея України. — 1-е вид. — Х.: РІРЕГ, 2001. — 556 с.
3.Державна фармакопея України. — 1-е вид., допов. — Х.: РІРЕГ, 2004.
4.Коломієць І.В. Фізико-хімічні методи аналізу. — Х.: Вид-во НФаУ: Золоті сторінки, 2003.
5.Луцевич Д.Д., Мороз А.С., Грибальська О.В. Аналітична хімія: підручник. — 2-е вид. перероб. і доп. — К.: Медицина, 2009. — 416 с.
6.Шляніна А.В. Практикум з аналітичної хімії — К.: Медицина, 2010. — 141 с.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 212; Нарушение авторских прав?; Мы поможем в написании вашей работы!