
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розділ 1. Якісний аналіз неорганічних сполук
|
|
|
|
Лабораторний практикум
Систематичний і дробний хід аналізу
В якісному аналізі розповсюджена ситуація, коли одні йони заважають відкрити інші, в зв’язку з тим, що дають аналогічні реакції. Тому реакції треба комбінувати таким чином, щоб до того часу, коли приступають до відкриття будь-якого йона, всі йони, які заважають були відкриті і усунені попередніми операціями.
Така послідовність реакцій називається систематичним ходом якісного аналізу, він передбачає відкривання не окремо кожного катіону, а зразу цілими групами, для цього використовують групові реактиви, які осаджають всю групу катіонів.
У кислотно-лужній системі якісного аналізу катіонів групові реагенти – HCl і H2SO4 розведені, луги – KOH, NaOH, розчин аміаку NH3 ·H2O.
При аналізі аніонів – групові реагенти розчини BaCl2 і AgNO3.
Але використання групових реактивів пов’язане з довготривалими операціями - осадження, фільтрування, промивання і тощо.
Тому, дуже часто використовують дробний метод аналізу, який був введений в практику М.О. Тананаєвим, і який ґрунтується на використанні специфічних вибірково діючих реактивів і виконується в довільній послідовності в окремих порціях досліджуваного розчину.
Переваги дробного аналізу:
- більш швидкий при виконанні ніж систематичний;
- не має потреби у повному якісному дослідженні зразка;
- легко відтворюваний, можна повторити декілька разів.
Але якщо вплив заважаючих катіонів усунути не можна, використовується систематичний хід аналізу. На лабораторному практикумі якісний аналіз буде вивчатися нами поєднанням систематичного ходу аналізу розділення груп катіонів і дробного ходу аналізу катіонів в середині груп.
|
|
|
Основні етапи якісного аналізу:
- взяття проби і підготовка її до аналізу;
- попередні дослідження;
- одержання розчину зразка.
Способи переведення аналізованого зразка у розчин залежать від його хіміко-аналітичних властивостей, тобто це його розчинність у воді або у інших органічних та неорганічних розчинниках, термічна стійкість, кислотно-основні, окисно-відновні, електролітні властивості і т.д.
1.1. Класифікація аналітичних реакцій. Систематичний та дробний методи аналізу. Класифікація катіонів та аніонів
Якісний аналіз неорганічних сполук дає можливість визначити якісний склад індивідуальних неорганічних сполук або їх суміші. При цьому використовують аналітичні реакції як для розділення суміші, так і для виявлення речовини (або її структурних елементів). Аналітична реакція – це хімічне перетворення речовини, що аналізується, при дії аналітичного реагенту, яке супроводжується утворенням продуктів з характерними аналітичними ознаками. На результати проведення аналітичної реакції в розчинах впливають: температура, концентрація речовин, рН середовища, наявність других речовин (заважаючих, маскуючих, каталізуючих і ін.).
В практиці якісного аналізу мокрим способом найчастіше використовують такі аналітичні реакції (реагенти): групові, характерні, селективні (вибіркові), специфічні.
Групові реакції (реагенти) використовують для відокремлення катіонів чи аніонів певної аналітичної групи із складної суміші йонів. Наприклад, хлоридна кислота утворює малорозчинні осади з  іонами і є груповим реагентом на ці йони.
іонами і є груповим реагентом на ці йони.
Характерною реакцією називається аналітична реакція, яка властива тільки певному йону (речовині), за певних умов. Виявити певний йон характерною реакцією (характерним реагентом) можливо тільки при умові відсутності інших йонів у розчині. Наприклад, при аналізі катіонів ІІІ аналітичної групи за кислотно-основною системою виявити йон 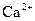 характерним реагентом амоній оксалатом можна лише за умови відсутності йонів
характерним реагентом амоній оксалатом можна лише за умови відсутності йонів 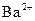 і
і 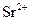 , оскільки вони з цим реагентом утворюють малорозчинні осади оксалатів.
, оскільки вони з цим реагентом утворюють малорозчинні осади оксалатів.
|
|
|
Селективна реакція дає однакові або подібні аналітичні ознаки з обмеженим числом йонів (2-5). Наприклад, до селективних реакцій відносяться взаємодія диметилгліоксиму (реактиву Чугаєва) з йонами 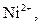
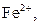
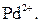 Селективність реакцій можна підвищити шляхом регулювання pH-розчинів, маскуванням певних йонів та ін. Високоселективна реакція, яка дає аналітичний ефект лише з одним йоном і будь-які інші йони в розчині її проведенню не заважають, називається специфічною. Реагент, який дозволяє виявити певний йон при наявності інших йонів, називається специфічним. Так, йони амонію
Селективність реакцій можна підвищити шляхом регулювання pH-розчинів, маскуванням певних йонів та ін. Високоселективна реакція, яка дає аналітичний ефект лише з одним йоном і будь-які інші йони в розчині її проведенню не заважають, називається специфічною. Реагент, який дозволяє виявити певний йон при наявності інших йонів, називається специфічним. Так, йони амонію 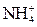 можна виявити лугом. В результаті реакції виділяється амоніак, який забарвлює вологий червоний лакмусовий папірець в синій колір. Цю реакцію можна проводити при наявності інших йонів у розчині, оскільки вона специфічна. Специфічні реакції дають можливість виявляти йони в окремих порціях розчину без будь-якої послідовності. Це найчастіше використовується в дробному методі аналізу.
можна виявити лугом. В результаті реакції виділяється амоніак, який забарвлює вологий червоний лакмусовий папірець в синій колір. Цю реакцію можна проводити при наявності інших йонів у розчині, оскільки вона специфічна. Специфічні реакції дають можливість виявляти йони в окремих порціях розчину без будь-якої послідовності. Це найчастіше використовується в дробному методі аналізу.
Суть дробного методу аналізу заключається в тому, що суміш йонів можна проаналізувати, використовуючи специфічні або дробні реакції. Дробними реакціями відокремлюють певний йон від інших йонів досліджуваного розчину (маскуванням, екстракцією чи іншими методами, 1-2 операції), потім його виявляють характерним реагентом. Якщо скористатися дробним методом аналізу неможливо, тоді (а це буває найчастіше) застосовують систематичний метод аналізу.
Систематичний метод аналізу передбачає розділення складної суміші йонів за допомогою групових реагентів на декілька окремих груп. Потім виявляють в певній послідовності окремо йони кожної аналітичної групи (кожен йон відокремлюється, а потім виявляється характерним на нього реагентом).
При виконанні різних досліджень велику увагу приділяють чутливості реакції. Чим меншу кількість речовини можна виявити за тією чи іншою реакцією, тим вона більш чутлива. Кількісно чутливість реакції характеризується: відкриваним мінімумом речовини, мінімальним об’ємом гранично розбавленого розчину, граничною концентрацією або граничним розведенням. Відкриваний мінімум m(x) – це найменша маса речовини (в мікрограмах), яку можна виявити за допомогою даної реакції в мінімальному об’ємі розчину. Мінімальний об’єм гранично розбавленого розчину Vмін – це об’єм розчину який містить відкриваний мінімум. Гранична концентрація С гран. – це відношення однієї масової частки йона або речовини в розчині до найбільшої маси розчинника. Оскільки розчинник – вода, то маса води в грамах заміняється на см3. Тобто гранична концентрація виражається в г/см3 або г/мл. Аналітична реакція тим чутливіша, чим менший відкриваний мінімум і гранична концентрація. Граничне розведення – величина, зворотна граничній концентрації ( ), виражається в см3/г або мл/г. Наприклад, при виявленні
), виражається в см3/г або мл/г. Наприклад, при виявленні 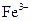 - іона реактивом
- іона реактивом 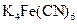 чутливість реакції характеризується Сгран. = 1:1000000 г/см3, а Vгран =1М106 см3/г. Тобто
чутливість реакції характеризується Сгран. = 1:1000000 г/см3, а Vгран =1М106 см3/г. Тобто 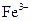 - іони масою 1г можна виявити в об’ємі 1000 дм3 (або 1000 л) води.
- іони масою 1г можна виявити в об’ємі 1000 дм3 (або 1000 л) води.
|
|
|
Взаємозв’язок між показниками чутливості виражається загальною формулою: 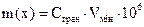 , мкг.
, мкг.
Чутливість реакції залежить від умов її виконання: концентрації речовини, рН середовища, наявності інших йонів, які заважають аналізу та ін. Тому, для підвищення чутливості реакцій, збільшують концентрацію речовини у розчині, попередньо видаляють або маскують йони, які заважають її виявленню, та ін.
Якісний аналіз неорганічних сполук поділяють на аналіз катіонів і аніонів, оскільки більшість неорганічних сполук є електролітами і у водних розчинах знаходяться у вигляді йонів. Виявлення катіонів найчастіше проводиться за систематичним ходом аналізу, оскільки присутність одних йонів заважає виявленню інших. Аналіз аніонів найчастіше проводять дробним методом.
Існує декілька систем аналізу катіонів: сульфідна, кислотно-основна, амоніачно-фосфатна та ін.
В основі класичної сульфідної системи якісного аналізу лежить різна розчинність сульфідів металів у воді. За розчинністю сульфідів катіони елементів діляться на п’ять аналітичних груп.
|
|
|
В основі амоніачно-фосфатної системи аналізу лежить різна розчинність фосфатів катіонів у воді та у водному розчині амоніаку.
Кислотно-основна система аналізу включає шість аналітичних груп і базується на різному відношенні катіонів до сульфатної та хлоридної кислот, лугів та розчину амоніаку.
Таблиця 1.1
Класифікація катіонів за кислотно-основним методом
| Група | Катіони | Груповий реагент | Сполуки, що утворюються | Групова характеристика |
| І | 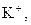 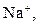 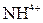
| Відсутній | Утворюють розчинні у воді хлориди, сульфати і гідроксиди | |
| ІІ | 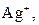 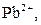 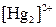
| 2 М розчин 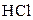
| Осад: 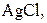  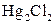
| Утворюють нерозчинні у воді хлориди |
| ІІІ | 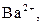  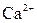
| 1 М розчин 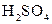 , етанол , етанол
| Осад: 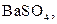  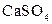
| Утворюють нерозчинні або погано розчинні у воді та кислотах сульфати |
| IV | 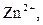 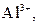  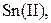 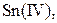 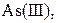 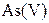
| Надлишок концентрова-ного розчину 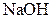 або або 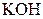
| Розчин:
 , ,  , ,  , , 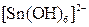 , , 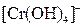 , , 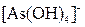 , , 
| Утворюють гідроксиди, нерозчинні у воді, але розчинні в надлишку лугу |
| V | 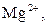 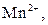  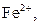   
| Надлишок концентро-ваного розчину амоніаку | Осад: 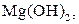 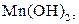   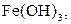 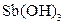 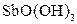
| Утворюють гідроксиди, нерозчинні у воді, надлишку розчину 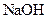 , та надлишку групового реагенту , та надлишку групового реагенту
|
| VI |    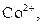 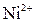
| Надлишок концентро-ваного розчину амоніаку | Розчин:
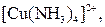 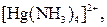 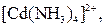  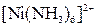
| Утворюють гідроксиди, які нерозчинні у воді та надлишку розчину 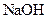 , але розчинні в надлишку розчину амоніаку , але розчинні в надлишку розчину амоніаку
|
Із існуючих систематичних методів аналізу катіонів у даному посібнику описано кислотно-основний метод, який має певні переваги, порівняно з іншими, в системі підготовки вчителя хімії і біології і давно впроваджений у практику навчального процесу педагогічних ВНЗ.
Аніони в більшості випадків не заважають виявленню один іншому, тому найчастіше їх виявляють дробним методом, тобто за допомогою окремих реакцій.
Незважаючи на це, при аналізі аніонів використовують і групові реагенти. Але їх використовують не для розділення аніонів, а для виявлення аніонів тієї чи іншої групи. Єдиного принципу розподілення аніонів на групи немає. Різні автори ділять аніони на групи, враховуючи певні їх властивості (окисно-відновні, розчинність певних сполук у воді та інше).
Класифікація аніонів у більшості випадків базується на різній розчинності солей Барію і Аргентуму певних аніонів у воді. Ми вивчимо характерні реакції тільки найпоширеніших аніонів, які поділяються на три окремі групи:
Таблиця 1.2
| Група | Аніони | Груповий реагент | Характеристика групи |
| І | 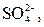 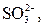 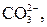 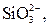 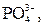  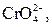 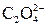
| 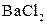 в нейтральному або слабкокислому розчині в нейтральному або слабкокислому розчині
| Солі Барію нерозчинні у воді |
| ІІ | 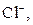  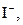 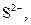 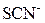
| 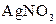 в присутності в присутності 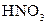
| Солі Аргентуму нерозчинні у воді і розведеній 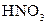
|
| ІІІ | 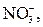  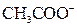
| Відсутній | Солі Барію і Аргентуму розчинні у воді |
1.2. Лабораторне обладнання та техніка напівмікроаналізу
Найчастіше у аналітичній практиці використовується напівмікрометод. При його використанні необхідно мати спеціальний хімічний посуд і обладнання. Реактиви зберігаються в спеціальному штативі, в якому є комірки для крапельниць (»90). Крапельниці з реактивами розміщуються в певному порядку. Щоб запобігти його порушенню, крапельниці і комірки мають етикетки.
При проведенні реакцій використовують пробірки циліндричні (висотою 5-6 см) і конічні (центрифужні). Необхідно також мати скляні палички, стакани, фарфорові чашки або тиглі, годинникові скельця, лійки для фільтрування, капілярні піпетки, промивалки, водяну баню, центрифугу та ін.
В якісному аналізі слід звертати увагу на чистоту хімічного посуду. Навіть невелике забруднення його може призвести до похибок при проведенні якісного аналізу. Хімічний посуд необхідно добре вимити, використовуючи механічні (за допомогою йорша) і хімічні методи очищення (миючі засоби, або хромову суміш – розчин з масовою часткою калій дихромату (VI)  5% в концентрованій
5% в концентрованій 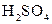 ). Потім декілька разів промити водопровідною водою і дистильованою водою (2-3 рази).
). Потім декілька разів промити водопровідною водою і дистильованою водою (2-3 рази).
При виконанні реакцій розчини переносять у пробірку за допомогою крапельниць, при цьому не можна торкатись крапельницею стінок пробірки (щоб запобігти забруднення реактиву).
рН середовища визначають так: краплю розчину переносять на індикаторний папір за допомогою скляної палички.
Для осадження можна використовувати конічні пробірки. До розчину, який досліджується, додають краплями осаджувач. Осад від розчину відділяють центрифугуванням. Для цього використовують електричну центрифугу. Центрифужні пробірки вміщують у гнізда центрифуги симетрично. Якщо в роботі тільки одна пробірка, тоді в протилежне гніздо вміщують таку ж пробірку, заповнену водою, з масою приблизно рівною масі першої пробірки (для рівноваги). Закривають кришкою центрифугу і вмикають її на 2-3 хв. Відкривати кришку і виймати пробірки можна тільки після повної зупинки центрифуги. Центрифугат (розчин) від осаду відокремлюють капілярною піпеткою. Якщо центрифугат не потрібний для подальшого аналізу, то його можна просто злити. При промиванні осаду до нього додають дистильовану воду, перемішують, центрифугують і розчин з осаду зливають.
Якщо осадження проводиться з метою розділення йонів, то необхідно перевіряти повноту осадження. Для цього до розчину над осадом додають одну краплю осаджувача. Якщо помутніння розчину не спостерігається, то це означає, що осадження повне. Якщо ж є помутніння, то додають ще декілька крапель осаджувача, центрифугують і ще раз перевіряють повноту осадження.
Після відділення осад можна розчиняти у центрифужній пробірці, додаючи краплями розчинник, і обережно (щоб не пробити пробірку) перемішуючи скляною паличкою.
Розчин у пробірках нагрівають на водяній бані з спеціальною металевою вставкою для пробірок. Водяну баню можна нагрівати на сітці газової пальнички, або на електроплитці. При необхідності замість бані можна використати термостійкий хімічний стакан, бажано, щоб він був зі вставкою з отворами для пробірок.
Кип’ятять розчини в хімічних стаканах або в фарфорових чашках (тиглях). Випарюють розчини в фарфорових чашках на повітряних або піщаних банях. Можна у фарфоровій чашці на фарфоровому трикутнику в полум’ї газової пальнички або на електроплитці.
Краплинні реакції можна проводити на фарфорових пластинках з заглибленнями, на предметних скельцях або на фільтрувальному папері (краще використовувати беззольні фільтри). Наносять 1-2 краплі розчину, що аналізується, і 1-2 краплі реактиву крапельною піпеткою або скляною паличкою.
Мікрокристалоскопічні реакції виконують на предметному скельці. Капілярною піпеткою наносять на скельце 1-2 краплі розчину, що аналізується, поряд 1-2 краплі реагенту і обережно з’єднують їх скляною паличкою. Потім скло розміщують на предметний столик мікроскопу (збільшення в 70-100 разів) і розглядають форму кристалів, які утворились на місці стикання крапель.
В практиці хімічного аналізу використовують реактиви чисті для аналізу (ч.д.а.) і хімічно чисті (х.ч.). Використовуються розведені розчини (найчастіше 0,1-0,2 М). Концентровані розчини кислот та лугів, органічні реагенти і розчинники та інші токсичні і небезпечні реактиви зберігаються у витяжній шафі. Усі реакції з їх використанням, а також реакції з виділенням токсичних газів, проводяться тільки у витяжній шафі.
На першому занятті учні проходять інструктаж з техніки безпеки. Під час роботи в лабораторії аналітичної хімії необхідно виконувати правила безпеки та підтримувати чистоту і порядок, оскільки виконання аналітичних операцій потребує великої уваги і акуратності.
Лабораторну роботу необхідно оформити в журналі для лабораторних робіт. Для цього необхідно записати усі виконані досліди та спостереження. Треба вказати досліджуваний йон, реагент, яким необхідно подіяти на цей йон, спостереження (зміна забарвлення, утворення або розчинення осаду, його вид, колір, виділення газу, його запах та ін.), скласти рівняння реакції, яка має місце в кожному окремому випадку. У висновках доцільно також вказати умови виявлення досліджуваного йона (температуру, середовище, послідовність приливання реактивів, необхідність перемішування, фільтрування, центрифугування та ін.).
Краще за все результати окремих реакцій йонів оформляти за такою схемою:
| Досліджуваний йон (речовина) | Реагент | Аналітичний сигнал | Рівняння реакції | Висновки |
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 603; Нарушение авторских прав?; Мы поможем в написании вашей работы!