
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа химического равновесия
|
|
|
|
Количественно равновесное состояние описывается константой химического равновесия Ke:
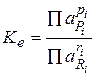
как отношение произведения равновесных активностей продуктов реакции к произведению активностей исходных веществ в степенях, равных стехиометрическим коэффициентам. В термодинамическую константу входят активности участников реакции. Так как равновесное количество может быть выражено и в других единицах (концентрациях, молях, мольных долях и т.д.), то используют и другие константы химического равновесия, например, концентрационная содержит равновесные концентрации с:
 .
.
Например, для реакции:
N2 + 3H2 ↔ 2NH3
 . В этом выражении формулы веществ в квадратных скобках символизируют молярные концентрации этих веществ: сi ≡[i].
. В этом выражении формулы веществ в квадратных скобках символизируют молярные концентрации этих веществ: сi ≡[i].
Свойства константы равновесия.
- Величина положительная: 0 < K < ∞. Чем больше Ke, тем более равновесие сдвинуто в правую сторону, в сторону продуктов реакции; чем меньше Ke, тем больше равновесие сдвинуто в сторону исходных веществ для данной записи.
2. Ke зависит от природы реакции и от температуры: для эндотермических реакций (ΔН > 0) увеличение Т смещает равновесие вправо, для экзотермических (ΔН < 0) − влево.
3. Kc не зависит от концентрации участников реакции: изменение концентрации одного из них приводит к изменению концентраций всех веществ так, что соотношение не меняется.
4. Для реакций, записанных наоборот, константы равновесия относятся как обратные величины:
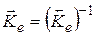 .
.
5. Ke связана со стандартным изменением энергии Гиббса ΔGо в ходе протекания реакции:
ΔG0 = − RTlnKe,
где R – универсальная газовая постоянная (8,31 Дж/моль·К);
T – температура в абсолютной шкале (о С+273) К.
6. Катализатор не влияет на Ke, изменяя лишь время достижения равновесия.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 190; Нарушение авторских прав?; Мы поможем в написании вашей работы!