
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. 1. Чем химические методы анализа отличаются от инструментальных?
|
|
|
|
Вопросы
1. Чем химические методы анализа отличаются от инструментальных?
2. В чем заключается условность понятия «степень окисления» атома элемента?
3. Какие аналитические реакции называются «сухими»?
4. На чем основано отнесение иона к той или иной аналитической группе?
5. Какие ионы открывают дробным анализом и при систематическом ходе анализа?
6. В каком виде отделяют амфотерные катионы при кислотно-щелочной системе?
7. Общие и отличительные реакции галогенид-анионов.
8. Сформулировать закон действующих масс.
9. Чем химическое равновесие отличается от механического?
10. Способы изменения равновесного состояния.
11. Какие проводники относят к электролитам?
12. Как степень ионизации молекул вещества зависит от его концентрации?
13. Связь общей константы ионизации многоосновной кислоты с константами отдельных ступеней.
14. Как подавить гидролиз соли слабого основания?
15. Расчет рН раствора соли, подвергающейся гидролизу.
16. Основные положения протолитической теории кислот и оснований.
17. Какие смеси обладают буферирующим свойством?
18. Анализ уравнения Henderson-Hasselbalсh.
19. Суть буферирующего действия на примере системы НСООН+НСООNa.
20. Связь растворимости малорастворимого соединения и его произведения растворимостей.
21. Как нерастворимый в кислотах ВаSО4 перевести в раствор?
Практические задания
1. Вычислить объем V соляной кислоты (плотность d=1,19 г/см3), который нужно взять для приготовления 500,0 мл 0,5000 N раствора.
а) V HCl=7,67 мл;
б) V HCl=9,25 мл.
2. Растворимость S сульфата кальция CaSO4 равна 1 г/дм3. Этот насыщенный раствор смешивают с равным объемом оксалата аммония (NH4)2C2O4, содержащего 0,0248 г соли в 1 л. Вычислить ионное произведение I концентраций оксалата кальция в момент сливания растворов и решить, образуется ли осадок CaC2O4. Произведение растворимости SPCaC  O
O  = 2,3∙10–9 (моль/л)2.
= 2,3∙10–9 (моль/л)2.
|
|
|
а) не образуется, т.к. IPCaC  O
O  =5,34∙10–10 (моль/л)2;
=5,34∙10–10 (моль/л)2;
б) образуется, т.к. IPCaC  O
O  =3,68∙10–7 (моль/л)2.
=3,68∙10–7 (моль/л)2.
3. Вычислить [H+] и pH 0,05 N раствора муравьиной кислоты.
Ki HCOOH= 1,772∙10–4.
а) [H+]=2,98∙10–3 моль/л; pН=2,53;
б) [H+]=2,51∙10–3 моль/л; pН= 2,60.
4. Как изменится pH раствора при добавлении 10,0 мл 1,0 N раствора соляной кислоты к 1 л ацетатной буферной смеси, состоящей из 0,10 N уксусной кислоты и 1,0 N ацетата натрия. Ki CH  COOH=1,754∙10–5?
COOH=1,754∙10–5?
а) ΔpH=0,05;
б) ΔpH=0,07.
1. Вычислить рН 0,25%-ного раствора аммиака. Ki(NH3·Н2О) = 1,74·10 –5.
Решение:
Раствор аммиака в воде является слабым основанием, ионизирующим по уравнению:
NH3 ·H2O 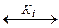 NH4++OH–
NH4++OH–
Ki= 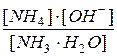 , откуда [OH–]=[NH4+] =
, откуда [OH–]=[NH4+] = 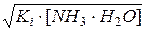 .
.
Пусть объем раствора Vр-ра =1 л, его плотность d=1 г/мл. Тогда в 1 л раствора содержится:
 =2,5 г NH3, откуда
=2,5 г NH3, откуда
СNH 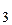 =[NH3·H2O]=
=[NH3·H2O]=  .
.
[OH–] = 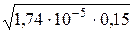 =1,60·10–3 моль/л.
=1,60·10–3 моль/л.
рОН = – lg[OH–] = –lg(1,60·10–3)=2,80.
рН =14,0–рОН = 14,0–2,80=11,2.
Ответ: рН р-ра NH3 = 11,2.
2. Вычислить произведение растворимости SP Fe(OH)3, если
растворимость его в воде S Fe(OH)  =2·10-3 г/дм3.
=2·10-3 г/дм3.
Решение:
Гидроксид железа (III) ионизирует по уравнению: Fe(OH)3↔Fe3++3OH–
Выражение произведения растворимости для него:
SP Fe(OH) 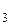 =[Fe3+]·[OH–]3.
=[Fe3+]·[OH–]3.
Можно показать, что растворимость S и произведение растворимости SP связаны выражением SP=(nn·mm)·S(n+m), где n, m ‑ число катионов и анионов соответственно:
SP=(11·33)·S(1+3)=27S4.
В приведенных формулах концентрации должны быть в молях на литр, поэтому:
S=2·10–8г/л= 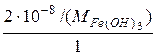 =
=  =1,87·10–10 моль/л,
=1,87·10–10 моль/л,
SP=27·(1,87·10–10)4=3,30·10–38 (моль/л)4.
Ответ: SPFe(OH) 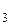 =3,30·10–38 (моль/л)4.
=3,30·10–38 (моль/л)4.
Литература
1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с.
2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с.
3. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с.
4. Цитович И.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с.
|
|
|
5. Васильев В.П. Аналитическая химия. - М.: высшая школа, 1989, Т. 1, 384 с.
6. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с.
7. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с.
8. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
Глава 3. Количественный химический анализ
Количественный анализ – совокупность методов (теоретических и практических) определения абсолютного или относительного содержания химических элементов в веществах и (или) веществ в смесях.
Оптические методы. Основаны на исследовании спектров поглощения, излучения и рассеяния веществ.
1. Фотометрический – изучение поглощения окрашенными веществами в видимой и УФ областях.
2. Нефелометрический – измерение рассеяния света коллоидными системами.
3. Эмиссионный спектральный – изучение спектров излучения (эмиссии) возбужденных атомов.
4. Фотометрия пламени – измерение интенсивности излучения при возбуждении пламенем с помощью фотоэлементов; чувствительность 10-3 г.
5. Л юминесцентный – измерение люминесценции (свечения) при возбуждении УФ. Интенсивность свечения ~ концентрации. Чувствительность 10-8÷-10 г.
6. Рентгеноспектральный – исследование вещества с помощью рентгеновских (Х) лучей по:
- характеристическому рентгеновскому излучению;
- анализу энергии испускаемых электронов – электронная спектроскопия.
Таблица 6
Методы количественного анализа
| Химические | Физические | Физико-химические | |||
| Гравиметрический (весовой) | Титриметрический (объемный) | Газовый | Используют взаимозависимость физических и химических свойств (например, концентрация раствора кислоты и плотность ее растворов) Определение состава вещества, не прибегая к химическим превращениям | Химические реакции, сопровождающиеся изменением физических свойств (например, электропроводимости, интенсивности окраски) | |
| - составная часть выделяется в виде осадка, масса которого определяется - убыль массы при нагреве - летучий компонент улавливается поглотителем, и определяют его массу | Измеряют объемы растворов, концентрация одного из которых известна – титрованный раствор | Определяют объемы газообразных веществ, обычно после поглощения сорбентами | |||
| Делятся на: 1. Оптические 2. Электрохимические 3. Хроматографические 4. Радиометрические | |||||
|
|
|
Электрохимические методы:
1. Электрогравиметрический. Электролиз с выделением веществ на электродах и их взвешивание (метод внутреннего электролиза здесь же).
2. Электротитриметрический (объемный). Эквивалентную точку определяют по изменению некоторых электрических свойств раствора.
3. Потенциометрический. Измеряют потенциал электрода.
4. Кондуктометрический. Измеряют электропроводимость системы.
5. Кулонометрический. Определяют количество электричества, идущего на окисление или восстановление вещества.
6. Вольтамперометрический. Изучают зависимость ток ‑ потенциал. Полярографический. Определяют величину диффузионного тока, пропорциональную концентрации вещества.
Масс-спектральный метод. Основан на разделении потока ионов в электрическом и магнитном поле в зависимости от отношения их массы к заряду. Чувствительность до 10–15 г.
Хроматографический метод. Основан на разделении смеси растворенных веществ, смеси газов, паров жидкостей сорбционным методом в динамических условиях. Существует жидкостная (колоночная, бумажная, тонкослойная), газо-жидкостная, газовая хроматография.
Радиометрический метод. Основан на измерении счетчиками Гейгера-Мюллера интенсивности излучения в единицу времени радиоактивных элементов, входящих в вещество. Чувствительность до 10–11 г.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 662; Нарушение авторских прав?; Мы поможем в написании вашей работы!