
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы установления правильности анализа
Результатов анализа
Физико-химические методы анализа
Решение
Решение
1 моль Pt образуется из 1 моль (NH4)2PtCl6, на образование которого идут 2 моль NH3. Фактор пересчета равен:
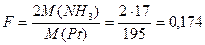 .
.
Ответ: F=0,174.
2. Из 1,450 г технического Na2SO3 приготовили 200 мл раствора. На титрование 20,0 мл его израсходовали 16,2 мл 0,0124 N раствора йода. Определить процентное содержание Na2SO3 в образце.
Приведен пример прямого титрования с протекающей реакцией
Na2SO3 +I2 + H2O = Na2SO4 + 2HI.
По закону эквивалентов
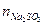
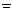
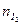
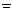
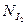
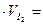 0,0124·16,2·10–3=2,01·10–4 моль.
0,0124·16,2·10–3=2,01·10–4 моль.
Это составляет:
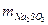
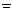
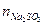 ·
· 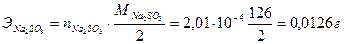 .
.
Это масса сульфита в 20 мл раствора, в 200 мл – 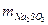
 0,126 г
0,126 г
Процентное содержание
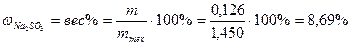 .
.
Ответ: 
Литература
1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с.
2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с.
3. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с.
4. Цитович И.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с.
5. Васильев В.П. Аналитическая химия. - М.: высшая школа, 1989, Т. 1, 384 с.
6. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с.
7. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с.
8. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
Глава 4. Правильность и статистическая обработка
Главное требование к анализу заключается в том, чтобы полученные результаты отражали истинное содержание элементов в пробе.
1. Проведение анализа несколькими независимыми методами. Например, свинец можно определять:
- гравиметрически в виде PbSO4;
- йодометрически через PbCrO4 по образовавшемуся I2;
- комплексонометрическим титрованием;
- электролитически по образующемуся на аноде PbO2.
2. Применение стандартных образцов с аттестованным содержанием элементов, указанном в паспорте. Методика верна, если найденное содержание элементов в стандартном образце соответствует паспортным данным.
3. Метод добавок. Ведут несколько параллельных определений, прибавляя к некоторым пробам точно известное количество определяемого элемента. Количество элемента в пробах с добавкой и без, должна соответствовать количеству добавки.
|
|
Дата добавления: 2017-01-14; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!