
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні вказівки 1 страница
ЗАПОРІЖЖЯ
МЕТОДИЧНІ ВКАЗІВКИ
до лабораторних робіт з органічної хімії
(для студентів біологічного факультету денного відділення)
Державний вищий навчальний заклад
“Запорізький національний університет”
Міністерства освіти і науки України
О.А. Бражко, Л.О. Омельянчик,
М.П. Завгородній, Д.С. Коваленко
до лабораторних робіт з органічної хімії
(для студентів біологічного факультету денного відділення)
Затверджено
вченою радою ЗНУ
Протокол № 4
від 26.12.2006 року
Запоріжжя
УДК: 547.1(076.5)
ББК: 24.2я73
О.А. Бражко, Л.О. Омельянчик, М.П. Завгородній, Д.С.Коваленко
Органічна хімія: Методичні вказівки до лабораторних робіт з органічної хімії (для студентів біологічного факультету денного відділення) – Запоріжжя: ЗНУ, 2007. – с.
Методичні вказівки містять рекомендації та учбові завдання з підготовки з лабораторно – практичних занять з курсу органічної хімії.
Призначений для студентів біологічного факультету спеціальності “Біологія” денної форми навчання.
Загальні методичні вказівки.
Ефективність лабораторно – практичних занять з органічної хімії залежить від рівня попередньо зробленої самостійної роботи студентів. Тому ці методичні матеріали містять рекомендації та учбові завдання з підготовки з лабораторно – практичних занять з курсу органічної хімії.
Самостійну роботу з підготовки до занять необхідно починати з ретельного вивчення теоретичного матеріалу за підручником і конспектом лекцій, а потім ознайомитись з відповідним посібником до практикуму.
Якість опанування вивченого матеріалу слід обов`язково перевірити, відповідаючи на питання та виконуючи вправи й завдання, які приведені у цьому посібнику до кожного з занять.
Кожне лабораторно – практичне заняття складається з двох частин. Одна з них відводиться на теоретичне заняття, включаючи групові семінари та різні вияви ступеня опанування теоретичного матеріалу. Друга, більша частина часу відводиться на виконання практичної роботи та оформлення звіту про роботу.
Мета теоретичною частини занять - поглиблення, поширення та закріплення знань, отриманих на лекціях. Цей вид практикуму сприяє розвиту у студентів хімічного мислення, привчає самостійно працювати з літературою та використовувати отримані знання при виконані лабораторної роботи.
З метою якісного опанування учбової програми з органічної хімії студентами передбачаються різні методи контролю знань. Вибір методу контролю зумовлено ступенем складності вивчаємого теоретичного матеріалу, його практичної значності. В якості основних форм поточного контролю використовується безмашинний контроль на картках, індивідуальний допит, контрольна робота.
Мета лабораторних робіт – закріплення студентами на практиці знань з загальних властивостей, характерних реакціям різних класів органічних сполук.
Лабораторний практикум побудований таким чином, що при його виконанні студенти ознайомляться з основними методами виділення, очищення, ідентифікації, отримання органічних сполук та їх властивостями, здійсняти ряд синтезів.
Перед початком лабораторного практикуму студентам слід обов’язково ознайомитись з правилами роботи у лабораторії та технікою безпеки.
Кожний студент в окремому робочому зошиті веде протокол знань. При оформлені протоколу вказується дата, назва теми, надається короткий опис дослідів, записуються основні реакції та їх механізми, результати спостережень та висновки.
Заняття 1
Правила роботи та техніка безпеки v лабораторії органічної хімії. Теорія будови органічних сполук А.М. Бутлерова. Електронна теорія органічних
Метою заняття є знайомство з правилами роботи та технікою безпеки при роботі у хімічній лабораторії, закріплення знань по теорії будови органічних сполук А.М.Бутлерова, поглиблення понять електронної теорії хімічного зв'язку, формування понять електронних ефектів в молекулах органічних сполук.
Вимоги до знань та уміння:
1. Знати та виконувати правила техніки безпеки при роботі у хімічній лабораторії.
2. Знати та вміти проілюструвати прикладами основні положення теорії будови органічних сполук А.М.Бутлерова.
3. Знати основні типи хімічного зв'язку та електронну будову атому вуглецю (sp3,sp2 , sp - гібридизація).
4. Знати засоби розриву хімічного зв'язку в органічних сполуках, електронну будову вільних радикалів, карбокатіонів та карбоаніонів.
5. Знати класифікацію органічних реакцій за напрямком та характером діючого реагенту.
6. Вміти пояснити та зобразити графічно розподіл електронної щільності
з урахуванням індукційного впливу замісників.
Види самостійних робіт.
1. Робота з підручником, опрацювання лекційного матеріалу.
Слід уважно ознайомитись з правилами техніки безпеки при роботі в,хімічній лабораторії та надання першої допомоги.
Звернути особливу увагу на діалектику уявлень хімічної будови, основні напрямки розвитку класичної теорії будови органічних сполук А.М.Бутлерова, успіхи та перспективи розвитку органічної хімії, співвідношення загально наукових та спеціальних методів пізнань в органічної хімії
2. Для закріплення теоретичних знань виконайте у робочих зошитах наступні вправи та задачі.:
2.1. Яким найбільш простим засобом можна довести структурну формулу етилового спирту?
2.2. Газоподібний вуглеводень має наступний елементарний склад: С-85,71%, Н-14,29%. Щільність його за воднем становить 21. Визначити молекулярну формулу цього вуглеводню.
2.3. Напишіть молекулярну формулу газоподібної речовини, яка має склад: 82,8%-С, 17,2%-Н, якщо відомо, що 1 л цього газу важить 2,59 г (Н.У.)
2.4.3найти молекулярну формулу речовини, якщо при спаленні 13.8г його ваги отримано 26,4 г CO2 та 16,2 г Н2О. Щільність його за повітрям становить 23.
2.5. Яки типи хімічного зв'язку мають місто у молекулі етану, хлорметану, оцтового альдегіду, оцтової кислоти, ацетату натрію?
2.6. Розгляньте електронну просторову будову наступних часток:
a)  б)
б) 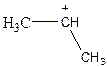 в)
в) 
2.7. Вкажіть типи перекриття електронних хмар, при утворенні наступних зв'язків:
а) С- Н в етані, етилені, ацетилені;
б) С - С в етані, етилені, ацетилені;
в)С -СІ;
г)С - О;
2.8. Пояснити та зобразити графічно розподіл електронної щільності в молекулах:
a) CH3 – CH2 – СІ, б) СН3 – СН2 –О – Н, в)  ,
,
г) 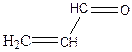 , д)
, д) 
Заняття 2
Насичені вуглеводні (алкани).
Метою занять є закріплення знань взаємозв'язку, складу, будови та властивостей алканів, формування вмінь та навиків виконання лабораторних дослідів, які демонструють властивості алканів, розпізнати вуглеводні насиченого ряду.
Контрольні запитання:
1. Напишіть структурні формули двох найближчих гомологів гептану, які мають в молекулі два третинних атоми вуглецю. Назвіть ці вуглеводні за раціональною та систематичною (ІЮПАК) номенклатурою.
2. Запропонуйте засіб одержання 2,3 - діметилбутану зі сполук, які мають в молекулі число атомів вуглецю 3,6,7.
3. Який об'єм повітря потрібен для спалення:
а) 12 л метану, б) 4,5 л етану, в) 4 л пропану, г) 9,8 л бутану. Скільки СО2 матимемо в кожному з цих дослідів?
4. Напишіть структурну формулу органічної речовини складу С5Н12 якщо відомо, що при її хлоруванні одержуємо третинну хлорпохідну, а при нітруванні - третинну нітросполуку. Поясніть, чому заміщення найбільш легко відбувається у третинного атому вуглецю?
5. Отримайте 3 - етилпентан:
а) гідруванням ненасиченого вуглеводню, б) відновленням галоген похідної.
Скільки ізомерних сполук можна використати для цього у кожному з випадків?
6. Перетворіть бромистий ізобутан у насичений вуглеводень.
а) 3 тією же будовою вуглецевого скелету.
б) З подвійним числом вуглеводневих атомів. Одержання метану та вивчення його властивостей.
Дослід1. Одержання метану та його горіння.
Реактиви та матеріали: натрію ацетат, зневоднений; натронне вапно; бромна вода, насичений розчин; перманганат калію, 1н розчин. Обладнання: газовідвідна трубка.
В суху пробірку, обладнану пробкою з газовідвідною трубкою містять суміш зі зневодненим оцтовокислим натрієм та натронним вапном (приблизно 1:2) (висота шару 6-10 Мм.), потім укріплюють горизонтально та гріють суміш у полум'ї пальника.
Хімізм процесу:
СН3СООNa +NaOH ® CH4 + Na2CO3
Підпалюють одержаний газоподібний метан на кінці газовідвідної трубки. Метан горить блакитно неяскравим полум'ям.
Хімізм процесу:
CH4 + 2O2® CO2 + 2H2O
При нагріванні натрієвої солі оцтової кислоти з натронним вапном відбувається розщеплення солі з утворенням метану. Нагрівання натрієвих солей, карбонових кислот з натронним вапном є загально - лабораторним засобом одержання насичених вуглеводнів.
Дослід 2. Відношення метану до бромної води та перманганату калію.
В пробірку містять 5 крапель розчину перманганату калію, а в іншу 3-5 крапель бромної води. Не зупиняючи нагрівання суміші в пробірці, запроваджують по черзі кінець газовідвідної трубки у пробірки. За звичайних умов алкани стійки до дії окислювачів.
Реакції заміщення в них йдуть у досить жорстких умовах, до реакцій приєднання алкани не здатні.
Дослід 3. Бромування насичених вуглеводнів.
Реактиви та матеріали: рідкі алкани; розчин брому в органічному розчиннику; аміак, 25%-й; лакмусовий папір синій.
Обладнання: пінцет, скляна паличка.
(Дослід проводять у витяжній шафі).
В суху пробірку містять 4 краплі суміші рідких алканів та додають 1 -2 краплі розчину брому. Склад пробірки змішують на холоді. Колір брому при цьому не зникає. Нагрівають вміст пробірки до зникнення забарвлення. До отвору пробірки вносять скляну паличку, змочену розчином аміаку, - з'являться білий димок NH4Br.
Пінцетом вносять до пробірки синій лакмусовий папір, змочений водою, лакмусовий папір червоніє.

2- метилбутан 2- бром – 2- метилбутан
Реакція бромування рідких алканів супроводжується виділенням бромистого водню і проходить значно повільніше, ніж бромування газоподібних алканів. Бромування йде швидше при доданні каталізаторів - залізних ошурок, амальгамірованого алюмінію, кришталевого йоду. Легше за все галогенують вуглеводні з третинним атомом вуглецю в молекулі, найважче всього заміщуються атоми водню у при первинному атомі вуглецю. Енергія зв'язку водню з третинним атомом вуглецю становить 90 ккал/ моль (376.8 кДж/моль), у вторинного; -94 ккал/моль(393.5 кДж/моль), а у первинного 99ккал/моль (414.5кДж/моль). Різниця у швидкості реакції галогенування особливо позначається при дії брому.
Дослід4. Окислення насичених вуглеводнів.
Реактиви та матеріали: рідкі алкани; перманганат калію, 1н розчин; вуглекислий натрій, 1 н розчин.
У пробірку містять одну краплю дослідженого алкану (або суміші алканів), 1 краплю розчину вуглекислого натрію та 2-3 краплі V перманганату калію. Вміст пробірки енергійно збовтують. Фіолетовий колір водного шару не змінюється.так як алкани за цих умов не окислюються.
Дослід 5. Дія концентрованої сірчаної кислоти на насичені вуглеводні.
Реактиви та матеріали: рідкі алкани; сірчана кислота концентрована (d=1.84r/см).
В пробірку містять 2 краплі рідкого алкану та 2 краплі сірчаної кислоти. Вміст пробірки енергійно перемішують 1-2 хвилини, охолоджуючи пробірку проточною водою. За умов досліду алкани з сірчаною кислотою не реагують При невеликому нагріванні сірчана кислота утворює з алканами, які містять третинний атом вуглецю, сульфокислоти. За високих температур сірчана кислота діє як окислювач.
Дослід 6. Дія концентрованої азотної кислоти на насичені вуглеводні.
Реактиви та матеріали: рідкі алкани; азотна кислота (d=1.4г/см) В пробірку містять 2 краплі дослідженого алкану та додають 2 краплі азотної кислоти. Суміш збовтують на протязі 1-2 хвилин. Ніяких змін в пробірці не спостерігають.
Концентрована азотна кислота на холоді не реагує з алканами, при високій температурі вона діє, як окислювач.
Реакція нітрування алканів добре йде з розмішаною азотною кислотою при нагріванні та підвищеному тиску. Легше за все нітруються алкани, які містять в молекулі третинний атом вуглецю. Алкани легко нітруються у газовій фазі двоокісю азоту або парами азотної кислоти при 250-500 С. Ця реакція йде за радикальним механізмом.
Заняття 3
Насичені вуглеводні ряду етилену (алкени).
Метою занять є закріплення знань про взаємозв'язок складу, будови та властивостей алкенів; поглиблення понять подвійного зв'язку; формування вмінь та навиків виконання лабораторної роботи, яка демонструє властивості алкенів; розпізнавання вуглеводнів ненасиченого характеру.
Контрольні запитання.
1.Напишіть реакції дегідрогенізації бутану, ізопропану. Назвіть продукти реакції.
2. Напишіть схему дегідратації бутилового спирту у присутності сірчаної кислоти.
3. Отримайте вуглеводні етиленового ряду з 1-хлорпентану, 2- йоду-2-метилбутану.
4. Чи відрізняються геометричні ізомери за температурою кипіння та плавлення, за щільністю, за дипольним моментом?
5. Напишіть структурні формули всіх етиленових вуглеводнів, які утворяться при дегідруванні 3,4-діметилгексана.Назвіть їх за номенклатурою ІЮПАК.
6. За допомогою яких реакцій можна розрізнити ізомерні сполуки 2-метил -2-пентен та 3-метил - 2 - пентен?
Дослід 1 Одержання етилену та його горіння.
Реактиви та матеріали: етиловий спирт - 96% розчин; сірчана кислота (d=1.84г/см)
До сухої пробірки містять декілька крихт піску, б крапель етилового спирту та 8 крапель концентрованої сірчаної кислоти..3ачиняють пробірку пробкою з газовідвідною трубкою та обережно гріють суміш у полум'ї пальника. Газ, який виділяється з пробірки, підпалюють на кінці газовідвідної трубки - він горить яскравим полум'ям.
Хімізм процесу:
 етилсірчана кислота
етилсірчана кислота
 Етилсірчана кислота-моноефір неорганічної двохосновної кислоти - при нагріванні розкладається:
Етилсірчана кислота-моноефір неорганічної двохосновної кислоти - при нагріванні розкладається:
CH3 – CH2 – OSO3H ® CH2= CH2 + H2SO4
Таким чином при взаємодії етилового спирту з сірчаною кислотою відбувається дегідратація спирту:

Одержаний етилен горить яскравим полум'ям:
С2H4 + 3O2 ® 2CO2 + 2H2O
Дослід 2. Приєднання брому до етилену.
Реактиви та матеріали: етилен; бромна вода, насичений розчин. Не зупиняючи нагрівання пробірки з сумішшю спирту та сірчаної кислоти, (див. Дослід 1), опускають кінець газовідвідної трубки до пробірки з 5 краплями бромної води. Бромна вода швидко знебарвлюється внаслідок приєднання атомів брому за містом подвійного зв'язку.
Реакція знебарвлення водного розчину брому є якісною реакцією на подвійний зв'язок.
Хімізм процесу:
CH2 = CH2 + Br ® CH2Br – CH2Br
1,2 - диброметан
Дослід 3 Відношення етилену до окислювачів.
Реактиви та матеріали: етилен; перманганат калію, 0.1н розчин. Не зупиняючи нагрівання пробірки з сумішшю спирти та сірчаної кислоти (див. дослід 1), опускають кінець газовідвідної трубки у пробірку з 2ма краплями розчину перманганату калію та 4ма краплями
води. Розчин перманганату калію швидко знебарвлюється. При цьому алкен окислюється у двоатомний спирт.
Ця реакція є якісною реакцію на подвійний зв'язок.
Хімізм процесу:

етиленгліколь
Дослід 4. Бромування ненасичених вуглеводнів.
Реактиви та матеріали: рідкі алкени (гас); розчин брому в органічному розчиннику, 25% розчин аміаку; лакмусовий папір синій.
(Дослід проводять у витяжній шафі).
До сухої пробірки містять одну краплю суміші рідких алкенів, додають 1- 2 краплі розчину брому та перемішують суміш.Якщо жовтий колір не зникає, то суміш нагрівають у полум’ї ї пальника до зникнення кольору. В пробірку вносять синій лакмусовий папір, попередньо змочений водою. Колір лакмусового паперу не змінюється. Розчин аміаку внесений на скляній паличці у пробірку не викликає утворення білого диму.
Приєднання брому за містом подвійного зв'язку йде за електрофільним механізмом з утворенням проміжного комплексу.
Хімізм процесу:

2 – метил – 2 – бутен 2,3 – дибром – 2 - метилбутан
Дослід5. Окислення ненасичених вуглеводнів.
Реактиви та матеріали: рідкі алкени; перманганат калію, 0.1н розчин; карбонат натрію, 1н розчин.
До пробірки містять 1 краплю рідкого алкену, 1 краплю розчину вуглекислого натрію та додають при енергійному збовтуванні 2-3 краплі розчин перманганату калію. Фіолетовий колір зникає та з'являється брунатний колір від утвореного двооксиду марганцю.
Хімізм процесу:

2 – метил – 2,3 – бутандіол Реакція окислення алкенів перманганатом калію у нейтральному, або лужному розчині є аналітичною реакцією на подвійний зв'язок. За більш жорстких умов - у кислому середовищі, а при нагріванні - відбувається розщеплення молекули за містом подвійного зв'язку. За продуктами окислення встановлюється структура алкену та положення подвійного зв'язку
Дослід 6. Дія концентрованої сірчаної кислоти на ненасичені вуглеводні.
Реактиви та матеріали: рідкі алкени, сірчана кислота, (d=l.84г/см) До пробірки містять 2 краплі рідкого алкену та 2 краплі сірчаної кислоти. Вміст пробірки добре перемішують упродовж 1-2 хвилин, охолоджуючи пробірку холодною проточною водою. Суміш розігрівається, шар алкену зникає.
Хімізм процесу:

2 – метил – 2 – бутен ізоамілсірчана кислота
Сірчана кислота взаємодіє з алкенами із утворенням алкілсірчаних кислот. Цю реакцію використовують в газовому аналізі для виділення газоподібних алкенів з їх суміші з іншими газами та для одержання спиртів.
Дослід 7. Дія концентрованої азотної кислоти на ненасичені вуглеводні.
Реактиви та матеріали: рідкі алкени; азотна кислота,(d= 1.4г/см). До пробірки містять 2 краплі алкену, який досліджують, та додають 2 краплі азотної кислоти. Вміст пробірки трясуть упродовж 1 хвилини. Суміш. розігрівається та буріє. Внаслідок реакції утворюється складна суміш, яка містить смолоподібні продукти Алкени здатні також приєднувати вищі окисли азоту та хлористий нітрозил CINO з утворенням нітрозитів та нітрохлоридів

Заняття 4.
Алкіни та дієнові вуглеводні.
Контрольні запитання:
1. Напишіть структурні формулу всіх ацетиленових вуглеводнів які утворюються при гідруванні 2,2-діметилгексану.
2. З карбіду кальцію отримайте бутін-1, а з бромистого бутилу отримайте бутін-2
З. Напишіть структурні формули ізомерних ацетиленових вуглеводнів C7H12,головний ланцюг яких складається з 5 атомів вуглецю. Назвіть їх.
4. За допомогою яких реактивів та за яких умов можливо здійснити перетворення:
а) Пентан-1 в пропілацетилен
б) 3,3- диметилбутен-1 в 3,3- диметилбутін-1
в) Гексан-1 в бутилацетилен
5. Напишіть структурні формули ізомерних дієнових вуглеводнів C5H9. Назвіть їх. Зверніть увагу на цис- та транс ізомерію.
Хід роботи:
Дослід 1. Одержання ацетилену та його горіння.
Реактиви та матеріали: карбід кальцію СаС2(в шматках).
Роботу з ацетиленом треба проводити у витяжній шафі, так як неочищений ацетилен, одержаний з карбіду кальцію, вміщує шкідливі, з неприємним запахом суміші. В пробірку містять шматочок карбіду кальцію СаС2, додають 2 краплі води та зачиняють пробірку пробкою з газовідвідною трубкою, яка має відтягнений кінець. В пробірці бурхливо виділяється газоподібний ацетилен.
Хімізм процесу:
СаС2 + 2Н2О ® НСºСН + Са(ОН)2
Підпалюють ацетилен на кінці газовідвідної трубки. Він горить яскравим копченим полум'ям.
Дослід 2. Приєднання брому до ацетилену.
Реактиви та матеріали: ацетилен, бромна вода, насичений розчин. Додають в пробірку з карбідом кальцію (див. Дослід 1) ще 2 краплі води, та зачиняють пробкою з газовідвідною трубкою, кінець якої опускають у пробірку з 5 краплями бромної води. Бромна вода знебарвлюється внаслідок приєднання атомів брому містом потрійного зв'язку.
Хімізм процесу:

1,1,2,2 - тетрабромметан
Дослід 3 Відношення ацетилена до окислювачів. Реактиви та матеріали: ацетилен; перманганат калію, 0.1н розчин. У пробірку містять 1 краплю перманганату калію та 4 краплі води. В пробірку зі шматками карбіду кальцію додають ще 2 краплі води та зачиняють пробкою з газовідвідною трубкою, кінець якої опускають до приготовленого розчину перманганату калію. Рожевий розчин швидко знебарвлюється: відбувається окислення ацетилену за містом розриву потрійного зв'язку з утворенням проміжного продукту окислення - щавельної кислоти, яка окислюється далі до двооксиду вуглецю:

щавлева кислота
Знебарвлення бромної води та розчину перманганату калію доводить ненасиченість ацетилену.
Дослід 4. Утворення ацетиленіду срібла.
Реактиви та матеріали.: ацетилен; нітрат срібла, 0,2н розчин; аміак, концентрований розчин.
До пробірки вносять 2 краплі нітрату срібла та додають 1 краплю розчину аміаку - утворюється осад гідроксиду срібла.При добавлені 1-2 крапель розчину аміаку осад AgOH легко розчиняється з утворенням аміачного розчину оксиду срібла.
Реакція протікає за наступним рівнянням:
AgNO3 + NH4OH ® AgOH + NH4NO3
2AgOH ® Ag2O + H2O
Ag2O + 4 NH4OH ® 2[Ag(NH3)2]OH + 3 H2O
Через аміачний розчин оксиду срібла пропускають ацетилен. В пробірці утворюється світло-жовтий осад ацетиленіду срібла, який потім стає сірим.
Хімізм процесу:
НСºСН + 2[Ag(NH3)2]OH ® Ag – C º C – Ag + 4NH4 + 2H2O
ацетиленісте срібло
Дослід 5. Утворення ацетиленіду міді.
Реактиви та матеріали: карбід кальцію, хлорид міді CuCl, аміачний розчин.
До сухої пробірки містять 1 -2 шматочка карбіду кальцію та додають 2 краплі води. До отвору пробірки вводять смужку фільтрованого паперу, змоченого аміачним розчином хлориду міді CuCl, який містить комплексний аміакат складу. З'являється червоно-буре забарвлення внаслідок утворення ацетиленіду міді.
Хімізм процесу:
НСºСН + 2 CuCl ® Cu – СºС – Cu + 2 HCl
ацетиленіста мідь
2HCl + 2NH3 ® NH4Cl
У водних розчинах ацетиленіди срібла та міді стійки. У сухому стані при нагріванні, або при вдарі вони вибухають зі значною силою. Атоми водню груп СН можуть бути заміщені металами. Це пояснюється тим, що атом вуглецю при потрійному зв'язку має підвищену електро-негативність та електронну хмару зв'язку С-Н зміщену вбік атому вуглецю. Атом водню стає більш позитивним та легше відривається у вигляді протону:
d+ d- d- d+
Н ® С º С Н
Заняття 5.
Ароматичні вуглеводні.
Контрольні запитання:
1.Напишіть структурні формули всіх ізомерних вуглеводнів бензольного ряду складу С8Н10 Назвіть їх.
2. Отримайте усіма відомими Вам засобами етилбензол. Напишіть можливі шляхи його окислення.
3. Встановити будову ароматичного вуглеводню С8Н10 при окисленні.якого отримується фенілдикарбонова кислота, а при нітруванні лише одну мононітропохідну.
4. З бензолу отримайте О- хлорбензойну кислоту.
5. Здійсніть нітрування:
а) хлорбензолу, б) етилбензолу, в) бензойної кислоти, г) О- нітроетилбензолу.
Хід роботи:
Дослід 1. Проба на ароматичну структуру.
Реактиви та матеріали: хлороформ, ароматичний вуглеводень, хлорид алюмінію, зневоднений.
До пробірки додають 5 крапель ароматичного вуглеводню та вносять на кінці мікро лопатки зневоднений хлорид алюмінію. Вміст пробірки ретельно збовтують. Поступово з'являється колір найрізноманітніших відтінків, при відстоюванні переходить у коричневий колір.
Цей дослід можливо здійснити як пробу на ароматичну структуру з будь якою ароматичною сполукою.
Дослід 2.
Реактиви та матеріали: бензойний натрій, натронне вапно; сірчана кислота, концентрована (d=l,84 г/см).
До сухої пробірки містять кілька заздалегідь приготовлених суміші їх бензойнокислого натрію та натронного вапна (II) Пробірку закріплюють в штативі горизонтально й зачиняють пробкою з газовідвідною трубкою, кінець якої опускають в іншу пробірку з водою, охолоджену кригою. Реакційну пробірку нагрівають у полум'ї пальника. Для того, щоб бензол переходив до приймача, спочатку нагрівають верхню частину пробірки, а потім вже реакційну суміш. Через деякий час у приймачі на поверхні води з'являється масляниста пляма бензолу. Після того як реакційна пробірка охолоне, її відчиняють. Відчувається характерний запах бензолу.
Хімізм процесу:
C6H5 – COONa + NaOH ® C6H6 + Na2CO3
бензойнокислий натрій бензол
Дослід 3. Властивості бензолу.
Реактиви та матеріали: бензол х. ч.; етиловий спирт, діетиловий ефір; бромна вода; перманганат калію, 0,1н розчин; сірчана кислота, 2н розчин.
а) розчинність бензолу у будь яких розчинниках. У 3 пробірки містять по 1 краплі бензолу. У одну пробірку додають З краплі води, в другу 3 краплі спирту, в третю 3 краплі ефіру. Вміст пробірок ретельно збовтують. У пробірці з водою утворюється 2 шари, в пробірках зі спиртом та ефіром одержуються однорідний розчин. Отже, бензол у воді практично не розчинень й добре розчиняється в органічних розчинниках.
б) горіння бензолу.(дослід проводять у витяжній шафі)
У фарфорову чашку містять 1 краплю бензол) та підпалюють. Бензол горить яскравим чадним полум'ям.
в) дія бромної води на бензол.
У пробірку містять 3 краплі бромної води та 2 краплі бензолу. Вміст пробірки енергійно збовтують та дають відстоятись. Нижній шар (бромна вода) знебарвлюється, а верхній шар (бензол)забарвлюється в брунатне - жовтий колір. Бром легше розчиняється в бензолі, ніж у воді, й тому переходить до верхнього бензольного шару.
Приєднання брому за цих умов не відбувається.
г) дія перманганату калію.
У пробірку містять 3 краплі води, краплю розчину перманганату калію та краплю розчину сірчаної кислоти. До отриманого розчину додають краплю бензолу та трусять вміст пробірки. Рожевий розчин при цьому не знебарвлюється. Для цього досліду бензол попередньо очищають від домішок, охолоджуючи його до +5 *С. При цьому бензол затвердіє, а домішки залишаються рідкими та легко відокремлюються. Перекристалізацію бензолу роблять 2-3 рази. Однією з важливих властивостей бензолу с його стійкість до дії окислювачів. Найбільш різка відзнака ароматичних вуглеводнів від ненасичених вуглеводнів жирного ряду - відношення до окислювачів.
Дослід 4. Окислення гомологів бензолу.
Реактиви та матеріали: толуол; перманганат калію, 0,1н розчин; сірчана кислота, 2н розчин.
До пробірки містять 3 краплі води, каплю розчину перманганату калію, та 1 краплю розчину сірчаної кислоти. Після цього додають краплю толуолу та енергійно трусять упродовж 1-2 хв. Рожевий колір поступово зникає, розчин знебарвлюється.
Хімізм процесу:

|
|
Дата добавления: 2015-08-31; Просмотров: 1379; Нарушение авторских прав?; Мы поможем в написании вашей работы!