
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчинність декстрану
|
|
|
|
Фізико – хімічні властивості очищеного декстрану
Його властивості залежать від штаму-продуценту, з якого він синтезується і від методу виробництва. Він являє собою аморфний світло-жовтий або білий порошок, який у воді утворює колоїдний розчин. Декстран має високу розчинність у воді і його розчини поводяться як ньютонівські рідини. В’язкість розчину залежить від концентрації, температури і молекулярної маси декстрану, що мають характерний розподіл [32].
Фракції декстрану добре розчиняються у воді і електролітах. Значення рН не робить істотного впливу на розчинність. Декстран також розчинний у деяких інших розчинниках, зокрема, сульфід метил, формамід, етиленгліколь, гліцерин. Фракції декстрану нерозчинні у одноатомних спиртах, наприклад, метанолу, етанолу та ізопропанолу, а також більшості кетонах, таких як ацетон і 2-пропанон [32].
Декстран — вуглевод, який містить розгалужені ланцюги залишків глюкози, які являються продуктами життєдіяльності бактерій та грибів. Завдяки відносно великій молекулярній масі, декстран повільно проникає через судинні стінки і при введенні в кров’яне русло, довго в ньому циркулює.
На основі декстрану було виготовлено препарати гемодинамічної дії з функцією нормалізації кислотно-лужного та електролітного балансу, який являє собою водний розчин декстрану з ММ 40000 кДа і містить додаткові компоненти: калій хлорид, кальцій хлорид, натрій хлорид. Є декілька видів препарату на основі декстрану: поліглюкін, поліглюсоль, поліоксидин, рондеферин, реоглюман та реополіглюкін [32].
 РОЗДІЛ 2
РОЗДІЛ 2
ХАРАКТЕРИСТИКА БІОЛОГІЧНОГО АГЕНТА
2.1 Обгрунтування вибору біологічного агента
Продуцентом декстрану є бактерії виду Leuconostoc mesenteroides. На даний час відомо декілька штамів даного виду бактерій: L. mesenteroides NRRL B512 (F), L. mesenteroides 05–19S, L. mesenteroides NRRL B512 (f), L. mesenteroides PCSIR-4, L. mesenteroides PCSIR-9, L. mesenteroides CMG713. Представлені штами бактерій синтезують декстран на поживному середовищі з сахарозою, концентрація якої в кожному випадку різна. Відповідно вихід продукту коливається в різних межах. Це є однією з головних відмінностей між мікроорганізмами. Також умови культивування мікроорганізмів різні, вони представлені в табл. 2.1 [1, 20, 26, 28, 29].
|
|
|
Таблиця 2.1 Порівняння штамів-продуцентів декстрану
| № | Продуцент | Поживне середовище (г/л) | Вихід продукту (г/л) | Час культивування (год) | Вихід декстрану від заданого субстрату, % |
| L. mesenteroides NRRL B512(f ) | Сахароза–20; Дріжджовий екстракт–20; K2HPO4–8 | 10 [9] | |||
| L. mesenteroides 05–19S | Сахароза — 50; дріжджовий екстракт — 0,001 дм3; MgSO4 × 7H2O — 0,10; КCl — 0,10; CaCl2 — 0,02; KH3PO4 –1; FeSO4 — 0,01; NH4Cl — 0,50; Na2HPO4 — 2,50; сіль Мора — 0,01; фолієва кислота — 0,05; сухий ферментативний пептон – 0,20; вода | 17 [1] | |||
| L. mesenteroides NRRL B512 (F) | Сахароза–100; дріжджовий екстракт–20,0; NaCl–0,01; MgSO4×7H2O–0,01; FeSO4×7H2O–0,01; CaCl2–0,05. | 40,8 [10] |
Продовження табл. 2.1
| L. mesenteroides PCSIR-4 | Сахароза–300; дріжджовий екстракт–5,0; пептон–5,0; К2НРО4–15; NaCl–0,01; MgSO4×7H2O–0,01; MnCl2×H2O–0,01; CaCl2–0,05. | 90,4 [10] | |||
| L. mesenteroides PCSIR-9 | Сахароза–100; дріжджовий екстракт–5,0; пептон–5,0; К2НРО4–5,0. | 37,9 [10] | |||
| L. mesenteroides CMG713 | 1) Сахароза–50, триптон–10; дріжджовий екстракт–1,0; К2НРО4–2,5; 2) Сахароза–150; пептон бактеріальний–5; дріжджовий екстракт–5; К2НРО4–15; МnCl2×H2O–0,01; NaCl–0,01; CaCl2–0,05. | 1) 12,40 [11] 2) 15,72 [11] | 1) 24 2) 24 | 1) 25 2) 10 |
З табл. 2.1 видно, що найбільшу кількість декстрану синтезує штам L. mesenteroides PCSIR-4. При внесенні в середовище 300 г/л сахарози синтезується 90,4 г/л полісахариду за 18 годин. Порівняно з іншими штамами, даний представник синтезує найбільшу кількість продукту за відносно невеликий проміжок часу (18 год) [28].
|
|
|
Розрахуємо вихід декстрану від заданого субстрату (сахароза) для кожного штаму–продуценту.
Загальна формула для розрахунку:
Y = 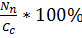 , де
, де
Nn – вихід продукту біосинтезу,
Сс – концентрація заданого субстрату.
L. mesenteroides NRRL B512(f ):
Y = 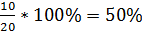 ,
,
L. mesenteroides 05–19S:
Y =  ,
,
L. mesenteroides NRRL B512 (F):
Y = 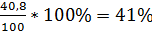 ,
,
L. mesenteroides PCSIR-4:
Y = 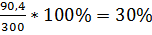 ,
,
L. mesenteroides PCSIR-9:
Y = 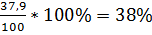 ,
,
L. mesenteroides CMG713:
Y1 = 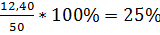 ,
,
Y2 = 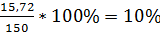 .
.
У інших штамів вихід продукту набагато менший, але кількість внесеного субстрату більша. Це економічно невигідно, адже завдання біотехнолога полягає у тому, щоб якнайменше затратити кошт на компоненти поживного середовища для вирощування мікроорганізмів, але при цьому отримати максимальну кількість продукту біосинтезу. Також у бактерій L. mesenteroides PCSIR-4 час культивування найменший, порівняно з іншими. Це є важливим показником, адже чим менше затрачено часу, тим швидше і більше ми отримаємо насинтезованого продукту [1, 20, 26, 28, 30].
Отже, в даному проекті, як продуцент буде використаний штам бактерій L. mesenteroides PCSIR-4 зважаючи на високі показники синтезу декстрану, виходу цільового продукту від заданого субстрату та малу тривалість процесу культивування бактерій.
2.2 Обгрунтування вибору складу поживного середовища
Поживне середовище для культивування мікроорганізмів повинно містити всі елементи, з яких складається клітина, причому в доступній для засвоєння організмом формі. Такими основними компонентами поживного середовища повинні бути: джерело вуглецю та енергії, джерела мінеральних сполук (азот, фосфор, сірка, калій, магній, кальцій, залізо та мікроелементи), а також (у разі потреби) і фактори росту [12].
Тільки невелика кількість елементів періодичної системи потрібна мікроорганізмам у відносно високих концетраціях (³ 10-4 М).). Це десять головних біологічних елементів: вуглець, кисень, водень, азот, сірка, фосфор, калій, магній, кальцій та залізо. Крім десяти головних біоелементів, мікроорганізмам необхідні мінорні біоелементи, джерелом яких, як правило, є водопровідна вода [12].
Поживні середовища, на яких вирощують мікроорганізми, мають відповідати таким мінімальним вимогам: у них мають бути присутні всі елементи, з яких будується клітина, причому в такій формі, в якій мікроорганізми здатні їх засвоювати [12].
|
|
|
До складу бактеріальної клітини входять такі елементи, % до маси сухої речовини: вуглець — 50; кисень — 20; азот — 10; водень — 8; фосфор — 3; сірка, калій, натрій — 1; кальцій, магній, хлор — 0,5; залізо — 0,2; решта елементів — близько 0,3 [12].
У природі більшість біологічних елементів міститься у вигляді солей, мікроорганізми поглинають їх у вигляді катіонів та аніонів. Велика різноманітність сполук, які використовуються мікроорганізмами, спостерігається тільки щодо сірки, азоту, кисню, водню, вуглецю [12].
Так сірка, як правило, споживається у вигляді сульфатів, відновлюється до сульфіду і потім використовується в біосинтетичних процесах.
Азот необхідний у великих кількостях, оскільки в клітині його міститься близько 10%. У природі азот зустрічається у вигляді аміаку, нітрату, нітриту, азотовмісних органічних сполук та молекулярного азоту. Кращим джерелом азоту для мікроорганізмів є аміак, який може використовуватися практично всіма мікроорганізмами. Нітрат спочатку відновлюється до аміаку і тільки після цього використовується в біосинтетичних процесах [12].
Вуглець, водень і кисень можуть споживатися у формі органічних та неорганічних сполук. Метаболізм цих сполук має велике значення не тільки тому, що ці елементи є важливими компонентами клітини, а й тому, що ці сполуки є субстратами для одержання мікроорганізмами енергії [12].
Для продуцента полісахариду декстрану штаму L. mesenteroides PCSIR-4 наведено декілька складів поживних середовищ (табл. 2.2).
Таблиця 2.2 Приклади поживних середовищ [28]
| Компоненти ПС | Кількість компонентів ПС (г/л) | |||
| № 1 | № 2 | № 3 | № 4 | |
| Сахароза | 100.00 | 300.00 | 100.00 | 100.00 |
| Дріжджовий екстракт | 5.00 | 5.00 | 5.00 | 20.00 |
| Пептон | 5.00 | 5.00 | 5.00 | – |
| K2HPO4 | 5.00 | 15.00 | – | – |
| NaCl | – | 0.01 | – | 0.01 |
| MgSO4×7H2O | – | 0.01 | – | 0.01 |
| MnCl2×H2O | – | 0.01 | – | – |
| FeSO4×7H2O | – | – | – | 0.01 |
| CaCl2 | – | 0.05 | – | 0.05 |
З наведених вище поживних середовищ було обрано поживне середовище № 2. Воно містить усі необхідні елементи, що входять до складу клітин і дає змогу накопичувати максимальну кількість декстрану (див. табл. 2.2) [28].
|
|
|
Сахароза є джерелом вуглецю;
Пептон – азоту;
K2HPO4 – джерело фосфору та кальцію;
NaCl – джерело натрію та хлору;
MgSO4×7H2O – джерело магнію, водню та сірки;
MnCl2×H2O – джерело марганцю та хлору;
FeSO4×7H2O – джерело заліза та сірки;
CaCl2 – джерело кальцію та хору.
Таблиця 2.3 Порівняння в’язкості продукту та його виходу [28]
| № ПС | L. mesenteroides PCSIR-4 | |
| Кількість декстрану, (г/л) | В’язкість, (сСт) | |
| 36,80 | 23,15 | |
| 90,40 | 20,64 | |
| 34,00 | 18,72 | |
| 39,60 | 25,08 |
На поживному середовищі № 2 синтезується найбільша кількість декстрану. Максимальна його кількість накопичується після 18 годин культивування, далі кількість продукту поступово зменшується, а в’язкість збільшується, що свідчить про високу молекулярну масу речовини. В’язкість декстрану, який утворюється на обраному нами ПС є оптимальною для того, щоб його можна було виділити та очистити. При подальшому збільшенні тривалості культивування спостерігається суттєве підвищення в’язкості декстрану до 25-27 сСт, що суттєво ускладнить процеси виділення та очищення продукту [28].
Таблиця 2.4 Порівняльна залежність виходу декстрану від кількості субстрату [28]
| Кількість сахарози г/л | Кількість декстрану г/л | Вихід декстрану від субстрату, % |
| 17,90 | ||
| 47,80 | ||
| 70,01 | ||
| 90,04 | ||
| 80,09 | ||
| 53,20 |
Кількість сахарози у базовому поживному середовищі складає 300 г/л, оскільки розрахунки економічного коефіцієнта показали, що саме при такій кількості вуглецевого субстрату можна отримати найбільший вихід продукту біосинтезу, а саме 30%. При збільшенні кількості сахарози у поживному середовищі, вихід декстрану від заданого субстрату зменшується (див. табл. 2.4), тому дана операція стає економічно неефективною [28].
Отже, з усього вище сказаного можна зробити висновок, що оптимальна концентрація сахарози складає 300г/л, в результаті отримуємо найбільший вихід декстрану (90,40 г/л або 30 %). Оптимальна тривалість культивування складає 18 годин. При подальшому збільшенні часу унеможливлюються операції виділення та очищення декстрану за рахунок підвищеної в’язкості речовини [28].
2.3 Обрахунок складу поживного середовища
Скласти базове поживне середовище для вирощування штаму L. mesenteroides PCSIR-4 – продуцента декстрану, якщо за 18 годин культивування концентрація декстрану в культуральній рідині становить 90,4 г/л, а концентрація біомаси 9 г/л [28].
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 559; Нарушение авторских прав?; Мы поможем в написании вашей работы!