
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Напишите реакции
Назовите вещества и определите степени окисления ВСЕХ элементов.
Работа над ошибками
| NaCl – | Na2SO4 – |
| NaF – | NaNO3 – |
| NaBr – | Na3PO4 – |
| NaI – | Na2CO3 – |
| Na2S – | Mg2C – |
| NaO – | Mg2Si – |
| Na2SO3 – | SiC - |
№2. Найдите в учебнике качественные реакции для обнаружения:
а) ионов СI-
б) ионов SO42-
в) ионов CO32-
г) ионов SiO32-
Сu + H2SO4(конц)→…
Сu + HNO3(конц)→…
№4. Решите задачу по образцу:
Гидроксид натрия полностью прореагировал с соляной кислотой. В результате реакции образовалось 27см3 воды. Вычислите какова масса гидроксида натрия, необходимая для реакции.
1. Записываем дано:
| Дано: V(H2O) = 27см3 _______________ Найти m(NaOH) -? | Решение: 2. Напишите уравнение реакции NaOH + HCl →NaCl + H2O 3.Уравняйте (в данном уравнении ничего уравнивать не нужно). |
3. Подчеркните известное вещество и неизвестное (известное – в «Дано», неизвестное – в «Найти»).
H2O – известное, NaOH – неизвестное.
NaOH + HCl →NaCl + H2O
4. У веществ, которые вы подчеркнули, определите количество молей.
NaOH + HCl →NaCl + H2O
1 моль 1 моль
NaOH – 1 моль, так как коэффициент в уравнении перед NaOH – 1
H2O - 1 моль, так как коэффициент в уравнении перед H2O – 1
Это значит, что из 1 моля NaOH получается 1 моль H2O
5. Определите, химическое количество известного вам вещества.
Известное вещество H2O. В дано нам сказано, что его объем 27 см3.
Мы знаем что вода в жидком агрегатном состоянии, и для нахождения химического количества нам нужна будет масса.
m (H2O) = V(H2O) ·ƍ(H2O)
m (H2O) = 27см3·1г/см3 = 27г
n(H2O) = m(H2O)/M(H2O)
M(H2O) = Mr(H 2O) = Ar(H)·2+Ar(O)= 1·2+16 = 18 (г/моль)
n(H2O) = m(H2O)/M(H2O) =  = 1,5 моль
6.Запишите найденное вами химическое количество в уравнение (так как мы нашли химическое количество воды, то пишем над водой). А над NaOH пишем x моль. Х – химическое количество NaOH.
Х моль 1,5 моль
NaOH + HCl →NaCl + H2O
1 моль 1 моль
7. Составьте пропорцию, и вычислите химическое количество NaOH. = 1,5 моль
6.Запишите найденное вами химическое количество в уравнение (так как мы нашли химическое количество воды, то пишем над водой). А над NaOH пишем x моль. Х – химическое количество NaOH.
Х моль 1,5 моль
NaOH + HCl →NaCl + H2O
1 моль 1 моль
7. Составьте пропорцию, и вычислите химическое количество NaOH.
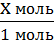 = =  8. По пропорции n(NaOH) = 1,5 моль. Найдем массу.
m(NaOH) = n(NaOH) ·M(NaOH)
M(NaOH) = 40 г/моль (как вычислить описано выше, на примере воды).
m(NaOH) = 1,5 моль ·40г/моль = 60 г.
Ответ: масса гидроксида натрия, необходимого для реакции – 60г.
8. По пропорции n(NaOH) = 1,5 моль. Найдем массу.
m(NaOH) = n(NaOH) ·M(NaOH)
M(NaOH) = 40 г/моль (как вычислить описано выше, на примере воды).
m(NaOH) = 1,5 моль ·40г/моль = 60 г.
Ответ: масса гидроксида натрия, необходимого для реакции – 60г.
|
Задача 1: Вычислите массу KOH, который израсходуется при реакции с HCI, если образовалось 54 см3 воды.
Задача 2. Какой объем воды можно получить, затратив кислород объемом 44,8дм3.
|
Дата добавления: 2017-01-13; Просмотров: 194; Нарушение авторских прав?; Мы поможем в написании вашей работы!